
비열용량(比熱容量, Specific heat capacity) 또는 비열은 단위 질량의 물질 온도를 1도 높이는 데 드는 열에너지를 말한다.
비열(Specific heat)이라는 용어는 특정 온도에서 물질의 비열 용량과 기준 온도에서 기준 물질의 비열 용량(예: 15 °C에서의 물) 사이의 비율을 나타낼 수도 있다.
정압비열 vs. 정적비열
비열은 물질의 종류에 따라서 결정되는 상수이며, 밀도, 저항률 등과 같이 물질의 성질을 서술하는 데 중요한 물리량이다.1g의 물의 온도를 1°C만큼 올리는 데 필요한 열량은 1cal이므로 물의 비열은 1이 된다. 그러나 비열은 단순한 숫자가 아니라 단위를 갖는 양이다. 1g을 1°C 올리는 데 필요한 칼로리수가 비열이므로 비열의 단위는 cal/g·°C이다. 따라서 정확하게 말하면 물의 비열은 1cal/g·°C가 된다.
정압비열 및 정적비열 개념
열 에너지를 물질에 주입하는 것은 온도를 높이는 것 외에도 샘플이 어떻게 제한되는지에 따라 보통 부피 및/또는 압력의 증가를 야기한다. 후자에 대한 선택은 동일한 시작 압력 p와 시작 온도 T에서도 측정된 비열 용량에 영향을 미친다. 두 가지 특정한 선택이 널리 사용된다.

<그림 1> 정적비열과 정압비열(He)
압력이 일정하게 유지되고 (예를 들어, 대기압하에서의 개방계 경우) 유체가 팽창할 수 있다면, 팽창은 압력의 힘이 인클로저나 주변 유체를 밀어낼 때 일(Work)을 한다. 그 일은 제공된 열에너지에서 비롯된 것이고, 이렇게 얻어진 특정 열 용량은 일정한 압력(또는 등가성)에서 측정된다고 하여, 정압비열(specific heat at constant pressure)이라고 하고, 종종 cp 로 표기된다.
반면에, 만약 팽창이 방지된다면 (예를 들어, 충분히 단단한 외함이나 내부 외압을 상쇄하기 위한 밀폐계), 외부 압력을 증가시는 어떠한 일(Work)도 하지 않고, 그 안으로 들어간 열에너지는 유체의 내부 에너지에 기여하게 된다. 이러한 방식으로 얻은 특정 열 용량은 일정한 부피(또는 등각성)에서 측정되어 정적비열(specific heat at constant volume)이라고 하고, 종종 cv 등으로 표시된다.
물질, 특히 기체의 특정 열용량은 팽창을 방지하는 밀폐된 용기에서 가열될 때(cv)보다 개방된 용기의 일정한 압력에서 가열될 때(cp)가 훨씬 더 높을 수 있다. 즉, cv 값은 보통 cp 값보다 작다.
이러한 차이는 일정한 압력 하에서 일반적으로 일정한 부피의 값보다 30~66.7% 더 큰 기체에서 특히 두드러진다.
열용량 비율(Heat capacity ratio)
열용량 비율(Heat capacity ratio)은 일정한 압력(cp)에서의 열 용량 대 일정한 부피(cv)에서의 열 용량 비율로서, 단열 지수(adiabatic index), 비열 비율(the ratio of specific heats)이라고도 한다.
이것은 때때로 등방팽창 인자(isentropic expansion factor )로 알려져 있으며 이상 기체의 경우 γ (감마) 또는 실제 기체의 등방팽창 지수(isentropic exponent) 인 κ (카파)로 표시된다.
이상 기체(Ideal gas)의 경우 열 용량은 온도에 따라 일정하다.
따라서 엔탈피(enthalpy) H = CpT로, 내부 에너지(enthalpy) U = CvT로 표현할 수 있다. 따라서 열용량비는 엔탈피 대 내부 에너지 사이의 비율이라고 할 수도 있다.
For ideal gas,
γ = cp / cv = H/U
가스의 열용량 비율 γ (감마)는 일반적으로 1.3에서 1.67 사이의 수치를 가진다.
여러가지 가스에 대한 열용량 비율은 다음 표와 같다.
<표 1> Heat capacity ratio for various gases
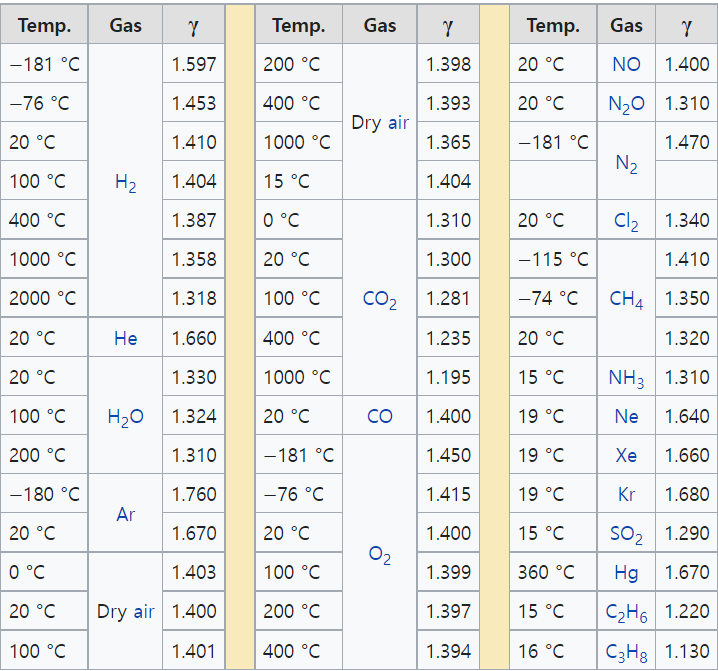
단위(Units)
| SI 단위(International system) | Imperial engineering units | 칼로리(Calories) |
| (J/K)/kg, J/(kg⋅K), J/(K⋅kg), J/(kg⋅°C) | BTU/(°F⋅lb) | cal/(°C⋅g) |
| 1 J/(g⋅K) = 0.001 J/(kg⋅K) | 1BTU/(°F⋅lb) = 4177.6 J/(kg⋅K) 1BTU ≈ 1055.06 J 1lb ≈ 0.454 kg |
1 cal/(°C⋅kg) = 4.184 J/(kg⋅K) 1 cal/(°C⋅g) ("small calorie") = 1 Cal/(°C⋅kg) = 1 kcal/(°C⋅kg) ("large calorie") = 4184 J/(kg⋅K). 1cal= 4.184 J ("small calorie", "gram-calorie") 1 kcal (Cal) = 1,000 cal("grand calorie", "kilocalorie", "kilogram-calorie") |
비열용량 관계식(Relation between specific heat capacities)
 |
α is the coefficient of thermal expansion, βT is the isothermal compressibility, ρ is molar density. |
| 이상기체에 대해서는 다음의 Mayer's relation을 적용 |
n is the amount of substance in moles Cp,m is the specific heat at constant pressure, Cv,m is the specific heat at constant volume R is the gas constant. |
비열용량 값
비열 용량은 상당히 일반적인 구성과 분자 구조의 기체, 액체 및 고체에 대해 정의되고 측정될 수 있다. 여기에는 가스 혼합물, 용액 및 합금 또는 우유, 모래, 화강암 및 콘크리트와 같은 이질적인 물질도 포함된다.
온도와 압력의 변화에 따라 상태나 조성이 변하는 물질에 대해서도 비열 용량을 정의할 수 있다. 예를 들어, 온도가 상승함에 따라 분해되는 기체나 액체에 대해, 분해의 생성물이 떨어질 때 즉각적이고 완전하게 재결합하는 한, 그 개념은 정의할 수 있다.
물질이 돌이킬 수 없는 화학적 변화를 겪거나, 측정으로 확장된 온도 범위 내에서 급격한 온도에서 녹거나 끓는 등의 위상 변화가 있을 경우 비열 용량은 의미가 없다.
비열 용량은 온도에 따라 달라지며 물질의 상태에 따라 달라진다.
다음 표를 참조하라.
<표 1> Table of specific heat capacities at 25 °C (298 K)
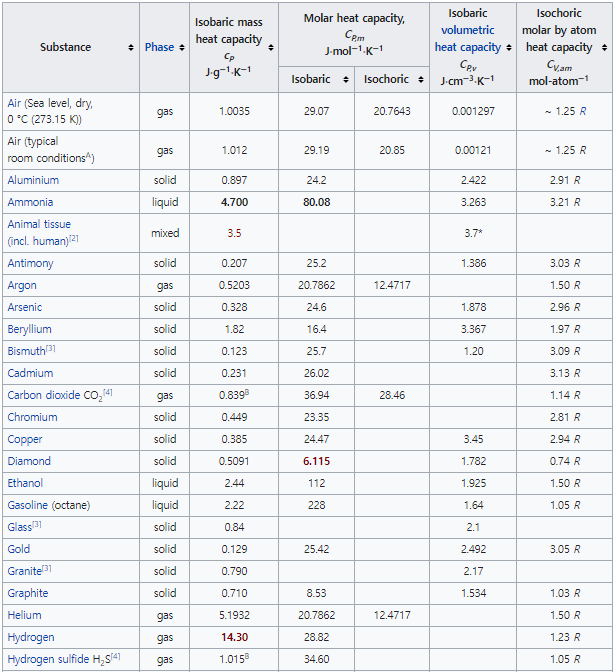

massic heat capacity : 물질의 열용량을 샘플의 질량으로 나눈 값 (J/(kg⋅K))
volumetric heat capacity(material) : 물질의 열용량을 샘플의 부피로 나눈 값 (J/(K⋅㎥))
molar heat capacity(chemical substance) : 화학 물질의 온도가 1단위 상승하기 위해 물질의 1몰에 열을 가하는 에너지의 양 (J/(K⋅mol))
물(Watwr)의 비열용량
액체 상태의 물은 20 °C에서 약 4184 J/(kg·K)로 일반적인 물질 중에서 가장 높은 비열 용량을 가지고 있지만, 0 °C 바로 아래의 얼음의 경우 2093 J/(kg·K)에 불과하다.
Water (liquid): cp = 4187 J/(kg⋅K) (15 °C)
또한 열의 단위로서 British thermal unit (BTU ≈ 1055.06 J)는 원래 물의 평균 비열 용량을 1 BTU/(°F·lb)로 정의되어 있다. 따라서, 1 BTU/(°F⋅lb) = 4177.6 J/(kg⋅K)가 된다.
또한, 아래 그림에서 빨간 선(dashed line)은 1 kg of ice at −50 °C의 얼음(ice) 1 kgdp 600 kJ의 열을 가하면 40 °C의 물이 되는 의미를 설면하고 있다.
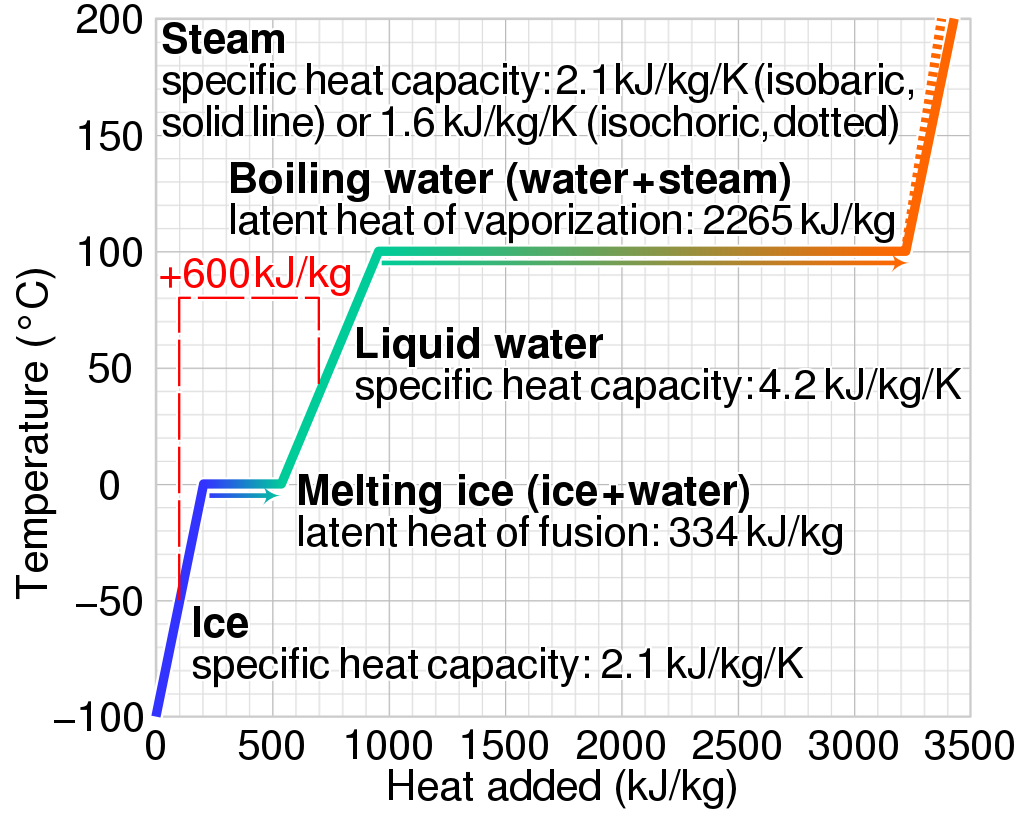
<그림 2> Graph of temperature of phases of water heated from −100 °C to 200 °C
Reference : https://en.wikipedia.org/wiki/Specific_heat_capacity
'공학 기술 > 공학기본' 카테고리의 다른 글
| 열역학 과정 (0) | 2021.12.18 |
|---|---|
| 열역학 제1법칙 (0) | 2021.12.18 |
| 이상기체 vs. 실제기체 (0) | 2021.12.03 |
| 상태량 표(열역학 성질표) (0) | 2021.12.03 |
| 상변화 과정에 대한 상태량 선도 (0) | 2021.12.01 |







댓글