
열역학 과정이란 열역학 제1법칙에 따라 기체가 외부의 환경에 영향을 받으면서 그 상태가 변화하는 과정이다.
열역학 과정
열역학 제1법칙을 다음과 같은 간단한 식으로 나타낼 수 있다.
ΔU=Q−W
· Q는 기체가 받은 열량이다.
· U는 내부 에너지로, 어떤 기체의 분자들이 가진 운동 에너지의 총합이다. 이때 U∝T (T:온도)인 관계가 성립한다.
* 따라서 ΔU는 내부 에너지 변화량
· W는 기체가 (외부에) 한 일의 양이며, W∝V인 관계가 성립한다.
이때 열역학 제1법칙에 따라 어떤 기체가 가진 열량은 그 물질의 내부 에너지와 그 기체가 한 일의 양의 합과 같다.
열역학 제1법칙에 대한 세부적인 내용은 기 포스팅한 다음 링크 자료 참조
https://sec-9070.tistory.com/562
열역학 제1법칙
열역학 제1법칙(first law of thermodynamics)은 보다 일반화된 에너지 보존의 법칙으로 표현으로, "어떤 계의 내부 에너지의 증가량은 계에 더해진 열에너지에서 계가 외부에 해준 일을 뺀 양과 같다."
sec-9070.tistory.com
단열 과정(Adiabatic process, Q=0)
단열 과정이란 열에너지의 출입 없이 일어나는 열역학 과정이다.
단열과정은 단열 팽창과 단열 압축으로 나눌 수 있는데, 단열 팽창은 기체의 부피가 늘어나면서 온도가 감소하고, 단열 압축은 기체의 부피가 줄어들면서 온도가 증가한다.
단열팽창을 하는 기체의 부피는 늘어나기 때문에 기체가 한 일의 양 W는 양수(+)가 된다. 그런데 기체의 부피가 증가하는 동안 외부의 열은 차단되어 있었기 때문에 Q=0이어야이여야 한다. Q 가 0이 되기 위해서는 ΔU가 음수(-)가 되어야 하고, 위에서도 말했듯이 U∝T이기 때문에 ΔU가 음수라면 온도의 변화량 역시 음수가 되어야 한다.따라서 단열 팽창을 하면 온도가 감소한다.
이를 정리해 보면 물체의 부피가 증가하면 내부 에너지는 감소하며, 내부 에너지는 온도에 비례하기 때문에 온도 역시 감소한다. 이것이 단열팽창 할 때 물체의 온도가 내려가는 이유이다. 단열 압축은 이와는 반대로 부피가 감소하고 온도가 상승한다.
* 자유팽창 과정 : 자유팽창은 계와 주위 사이에 열전달이 없고, 계가 일도 하지 않는 단열 과정의 일종이다. 열역학 제1법칙 E = Q - W에서 Q = W = 0인 경우로 E = 0이 된다.
자유 팽창에서 잠금 마개가 열리면 기체는 자유 팽창을 하여 양쪽 공간을 모두 채운다. 이때 두 공간은 단열되어 있으므로 외부와 열전달은 없다. 그리고 기체가 아무 압력도 받지 않고 진공으로 들어가므로 일도 없다.
등온 과정(Isothermal process, T=0)
등온 과정은 온도가 일정한 상태에서 일정량의 이상 기체가 열에너지를 흡수하여 부피가 증가하거나, 열에너지를 방출하여 부피가 감소하는 과정이다.
온도가 일정하다는 말은, 부피나 압력이 변하는 경우 어떤 식으로든 에너지 출입이 존재한다는 의미이므로 단열 과정과는 절대로 양립할 수 없다.
Q=ΔU+W=ΔU+PΔV 에서 등온 과정이므로 기체의 온도는 일정하다. 이는 기체의 내부에너지가 일정함을 의미한다. 따라서 내부에너지 변화량 ΔU=0 이므로 Q=W 가 된다. 열량과 일의 양이 같으므로 외부에서 열을 받게 되면 모두 외부에 일을 하는데 쓰이고, 외부로부터 일을 받으면 받은 일의 양만큼 외부로 열을 방출한다.
ΔT=0에서 PV=nRT가 일정하므로
PV=k라는 식으로 나타낼 수 있으며, 따라서 P−V곡선은 반비례 곡선이 된다.
이때,
W=∫PdV
이므로 등온 과정에서 한 일을 계산하면, 아래와 같다.
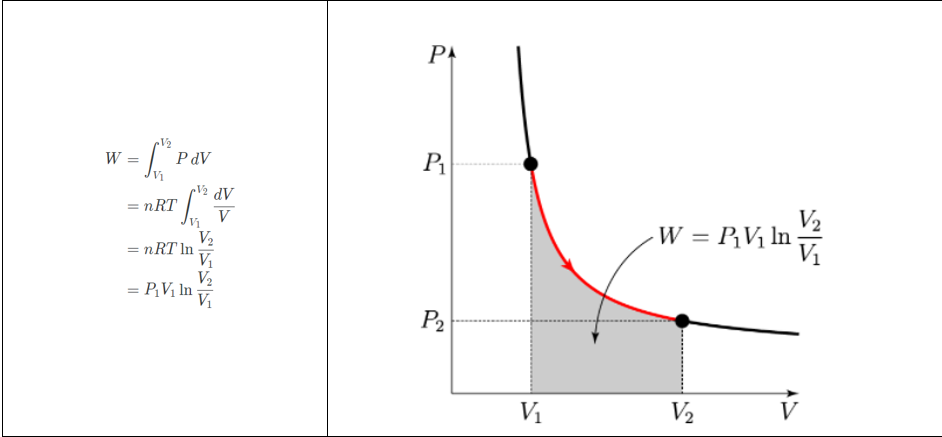
등적 과정(Isochoric process, V=0)
정적 과정이라고도 불린다. 일정량의 이상 기체의 부피가 일정한 상태에서 기체가 열에너지를 흡수하여 온도가 증가하거나, 열에너지를 방출하여 온도가 감소하는 과정이다.
Q=ΔU+W=ΔU+PΔV 에서 정적 과정이므로 부피는 항상 일정하다. 따라서 ΔV=0 이므로 Q=ΔU 가 된다. 열량과 내부 에너지 변화량이 같으므로, 외부에서 열을 받게되면 모두 내부 에너지의 증가로 쓰이게 된다. 반대로, 내부 에너지의 감소는 모두 열로 방출된다.
등압 과정(Isobaric process, P=0)
정압 과정이라고도 불린다. 일정량의 이상 기체의 압력이 일정하게 유지되면서 열을 흡수하여 부피가 증가하거나, 열을 방출하며 부피가 감소하는 과정이다. 즉 기체가 열팽창을 하는 것이다.
Q=0 혹은 W=0, ΔU=0 등 관계식 중에 한 변수가 0이 되었던 앞의 세 과정과 다르게, 등압 과정은 어느 것도 0이 되지 않는다. 하지만 다행히 이상기체의 상태 방정식(PV=nRT)과 몰 비열단원자 분자의 등적 몰 비열은R이고 등압 몰 비열은R)R) 관계식에 의해 단원자 분자의 경우, W=PΔV, ΔU=(3/2)nRT=(3/2)PΔV이고, Q=(5/2)*PΔV이라는 그래도 '비교적' 간단한 형태를 얻을 수 있다.
Reference : https://namu.wiki/
'공학 기술 > 공학기본' 카테고리의 다른 글
| TNT 등가성(Equivalency) (0) | 2021.12.28 |
|---|---|
| 과압으로 인한 폭풍 피해(Blast Damage) (0) | 2021.12.28 |
| 열역학 제1법칙 (0) | 2021.12.18 |
| 정압비열 vs. 정적비열 (0) | 2021.12.05 |
| 이상기체 vs. 실제기체 (0) | 2021.12.03 |





댓글