
상태량 선도란 순수물질의 상변화에 대한 압력, 온도, 비체적 간의 관계를 나타낸 도면을 의미한다.
상변화 과정에 대한 상태량 선도
T-v 선도
◆ 피스톤-실린더 장치에 있어 압력변화에 따른 변화를 관찰함
다음 그림은 온도(T)와 비체적(v, 혹은 체적)과의 관계를 나타낸 T-v선도 (온도-비체적 선도)이다.

<그림 1> T-v 선도 (온도-비체적 선도)
상기 그림에서 보듯이 T-v 선도에서 포화증기선과 포화액체선을 볼 수 있다.
- 포화액체선 saturated liquid line : 포화액 상태를 연결한 선
- 포화증기선 saturated vapor line : 포화증기 상태를 연결한 선
⇒ 액체가 가열되어서 포화온도까지 상승 → 포화액체상태를 거쳐 액체와 기체가 동시에 존재
→ 포화증기상태에 이른 후 → 과열증기
◇ 임계점, 유체, 초임계유체
⇒ 22.09MPa 곡선을 보면 등온과정 없이, 점만 존재하는데 이점을 임계점이라 한다.
⊙ 임계점 Critical point : 포화액체와 포화증기의 상태가 일치하는 점.
⊙ 임계점에서의 온도, 압력, 체적을 각각 임계온도, 임계압력, 임계체적라 부름.
임계점보다 높은 압력, 온도에서는 끓는과정이 없다. 액체와 기체의 상구분이 없어 ‘유체’라 명명한다.
예)
1) 물 : 임계온도 Tcr = 374.14℃, 임계압력 Pcr = 22.09MPa, 임계비체적 vcr = 0.003155 m3/kg
2) 헬륨 : 임게온도 Tcr = -267.85℃, 임계압력 Pcr = 0.23MPa, 임계비체적 vcr = 0.01444 m3/kg
⊙ 초임계유체: 일정한 고온과 고압의 한계를 넘어선 상태에 도달하여 액체와 기체를 구분할 수 없는 시점의 유체를 가리킨다. 분자의 밀도는 액체에 가깝지만, 점성도는 낮아 기체에 가까운 성질을 가진다. 또 확산이 빨라 열전도성이 높아 화학반응에 유용하게 사용된다. 즉, 기체의 확산성과 액체의 용해성을 동시에 지닌다고 할 수 있다.
⊙ 물은 압력이 상승할수록
1) 비등온도가 높아진다.
2) 포화액체의 비체적은 커지고, 포화증기의 비체적은 작아진다.
⇒ 포화액체와 포화증기상태를 잇는 수평선은 짧아진다.
⊙ 임계압력 이상의 압력상태 (P>Pcr)에서는
1) 분명한 상변화 과정phase-change process이 없다.
2) 물질의 비체적이 연속적으로 증가하여 단지 single-phase만이 존재한다.
3) 압축액체영역과 과열증기영역을 구분하는 선이 없다.
4) Tcr이상의 온도에 있는 물질은 과열증기, Tcr이하에 있는 물질은 압축액체
⊙ 상태영역
1) 압축액 영역 compressed liquid region : 포화액선의 왼쪽
2) 과열증기 영역 superheated vapor region : 포화증기선의 오른쪽
3) 포화액-증기 혼합물 영역 saturated liquid-vapor mixture region : 압축액 영역과 과영증기 영역의 사이
◇ 액체-기체 2상 영역에 대한 T-v선도

<그림 2> 액체-기체 2상 영역에 대한 T-v 선도
상기 그림에서는 건도와 비체적의 관계를 알 수 있다.
- 건도(quality, x): 증기의 질량분율 증기의 질량을 전체질량으로 나누어 구함. 전체질량은 대부분의 경우 증기질량 더하기 액체질량
- 비체적 : vg : 포화 증기 비체적; vf : 포화액체 비체적

P-v 선도
◆ 1MPa, 150℃에서 액상의 물이 담겨져 있는 피스톤-실린더 장치를 고려함.
⇒ 압력은 피스톤위의 추를 제거하면서 감소시키는 실험
다음 그림은 순수물질의 P-v 선도이다.
등온 하에서 압력과 체적과의 관계를 나타냄
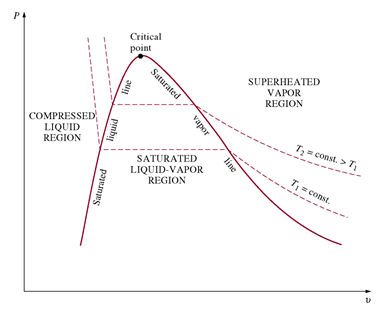
<그림 3> 순수물질의 P-v 선도
선도에서, 압력이 감소하면 체적이 증가하여, 기체가 액체, 그리고 액체가 고체로 변함을 알 수 있음
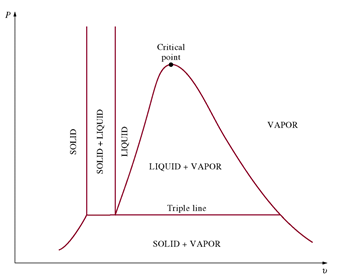
⊙ 고체상태를 포함한 선도의 연장
- 응고할 때 수축하는 물질의 경우와 응고할 때 팽창하는 물질(예: 물)의 경우
 |
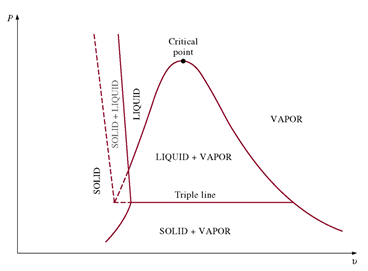 |
| <그림 4> 응고할 때 수축하는 물질의 P-v 선도(예: EO) | <그림 5> 응고할 때 팽창하는 물질의 P-v 선도(예: 물) |
P-T 선도 (상선도 phase diagram)
3개의 상이 3개의 선에 의해 분리되어 phase diagram이라고도 한다.
다음 그림은 압력과 온도에 따른 물질의 상변화를 보여주는 순수물질의 P-T 선도이다.

<그림 6> 순수물질의 P-T 선도
⊙ 승화선(고체-증기영역 분리), 증발선(액체-증기영역 분리), 융해선(고체-액체 분리)
- 고체가 액체로 변하는 것을 융해, 그 반대를 응고
- 액체가 기체로 변하는 것을 기화 혹은 증발, 그 반대를 액화 혹은 응축
- 고체가 액체를 거치지 않고 바로 고체가 되는 것, 혹은 그 반대를 둘다 승화
⊙ 기화선은 임계점에서 끝남
⊙ 얼 때 팽창하는 물질과 수축하는 물질은 P-T선도상에서 융해선이 다름
◇ 물의 P-T 선도
승화곡선을 따라 기체상과 고체상이 평형, 증발곡선을 따라 기체상과 액체상이 평형, 그리고 융해곡선을 따라 액체상과 고체상이 평형. 그리고, 임계점 이상의 초임계를 알 수 있다.
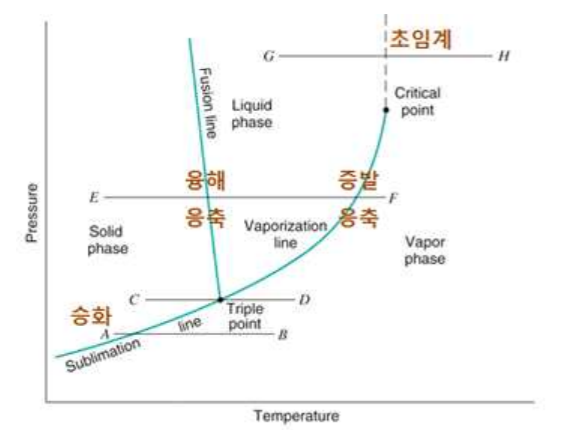
<그림 7> 물의 P-T 선도와 그에 따른 상변화
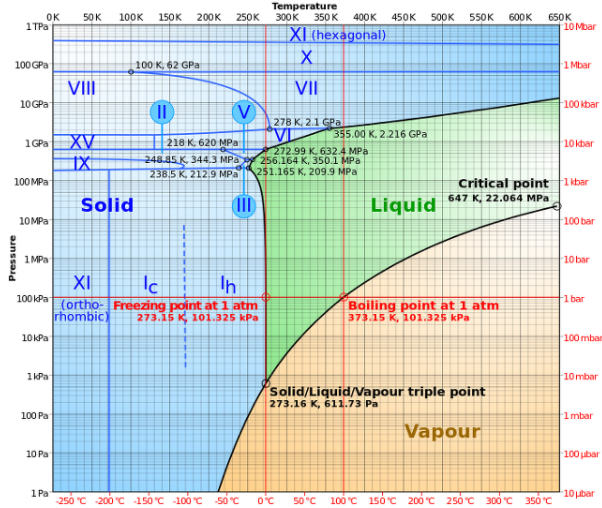
<그림 8> 물의 Phase Diagram
열린 용기에 담긴 액체를 가열하면 액체 표면으로부터 증발이 일어난다. 온도를 계속 올려서 증기 압력이 외부 압력과 같아지는 온도가 되면 액체 전체에서 증발이 일어나 증기가 주위로 자유롭게 퍼진다. 이처럼 액체 전체에서 자유 증발이 일어나는 현상을 끓음Boiling이라고 하며 액체의 증기 압력이 외부 압력과 같아지는 온도를 끓는점Boiling point라고 한다.
외부 압력이 1 atm일때 끓는 온도를 정상 끓는점normal boiling point이라고 한다. 그리고 외부 압력이 1 bar 일때 끓는 온도를 표준 끓는점standard boiling point라고 한다. 1 bar는 1 atm보다 약간 작다. 1.00 bar = 0.987 atm 이므로 액체의 표준 끓는점은 정상 끓는점보다 약간 낮다. 물의 정상 끓는점은 100 ℃이며 표준 끓는점은 99.6 ℃ 이다.
주어진 압력하에서 물질의 액체상과 고체상이 평형을 이루며 공존하는 온도를 녹는점melting point이라고 한다. 물질이 녹는 온도는 어는 온도와 같기 때문에 녹는점과 어는점freezing point은 같다. 마찬가지로 압력이 1 atm일 때 어는점을 정상 어는점normal freezing point 또는 정상 녹는점normal melting point라고 하며 1 bar 일때는 표준 어는점standard freezing point 또는 표준 녹는점standard melting point이라고 한다.
밀폐된 용기에서 액체를 가열하면 끓지 않는다. 온도가 올라가면 증기 압력이 증가하고 액체가 증발하기 때문에 증기 압력은 증가한다. 동시에 액체는 온도가 올라감에 따라 팽창을 해서 밀도가 감소한다. 마침내 증기의 밀도와 액체의 밀도가 같아지게 되면 기체와 액체 상 사이의 표면이 없어진다. 이때 표면이 없어지는 온도를 임계 온도critical temperature라고 하고 증기 압력을 임계 압력critical pressure이라고 한다. 임계 온도와 임계 압력을 상평형 그림에 표시한 곳이 임계점critical point이 된다. 임계 온도와 임계 압력 이상의 영역에서는 균일한 단일 상이 용기를 가득 채우며 계면이 없는데, 이를 초임계 유체supercritical fluid라고 한다.
압력과 온도의 조건을 맞추면 세 가지의 서로 다른 상, 일반적으로 고체, 액체, 기체가 모두 동시에 존재하며 평형을 이룰 수 있다. 세 상의 경계가 맞나는 점이 삼중점triple point이다. 물질의 삼중점은 물질마다 고유한 온도와 압력에서 나타낸다. 물의 삼중점은 273.16 K, 611 Pa(6.11 mbar, 4.58 Torr)이며, 삼중점이 변하지 않으므로 열역학적 온도를 정의하는데 기본이 된다.
Reference : 충남대 바이오시스템기계공학과 교재
'공학 기술 > 공학기본' 카테고리의 다른 글
| 이상기체 vs. 실제기체 (0) | 2021.12.03 |
|---|---|
| 상태량 표(열역학 성질표) (0) | 2021.12.03 |
| 순수 물질의 상변화 과정 (0) | 2021.11.30 |
| 순수물질의 상 (0) | 2021.11.30 |
| 열전달의 장애물 (0) | 2021.11.30 |





댓글