
열역학적 상태량 사이의 관계를 구성하는 방정식은 복잡하기 때문에 상태량을 table의 형태로 표기하여 활용하고 있다.
대표적으로 많이 활용하는 Table이 Steam tables(수증기표)이다.
상태량 표(열역학 성질표)
물질별로 열역학 성질표는 많이 존재하고, 일반적으로 형식은 동일하다.
수증기표(Steam tables)
물, 수증기가 열역학표를 설명하는 수단이자, 수증기가 열역학적 기관에 널리 쓰인다.
수증기표는 5개의 표로 구성
① Table B.1.1 : saturated water-temperature table (포화액체, 포화증기-온도기준 수증기표)
Table B.1.2 : saturated water-pressure table(포화액체, 포화증기-압력기준 수증기표)
② Table B.1.3 : superheated water-pressure table(과열증기-온도기준 수증기표)
③ Table B.1.4 : compressed liquid water-pressure table(압축액체-온도기준 수증기표)
④ Table B.1.5 : saturated ice-water vapor(포화 (고체-증기) 상태 )
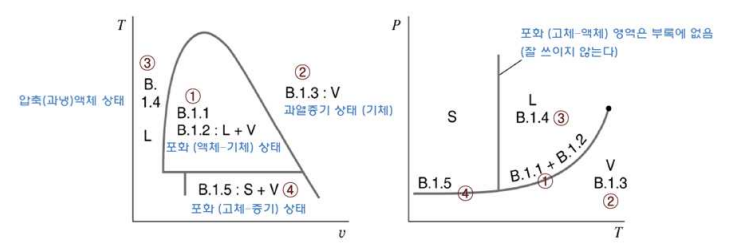
<그림 1> 상태량 선도에서 수증기표의 영역과 표
◆ 포화상태:
T-v 혹은 P-T 선도와 비교해 보면, 포화증기영역은 B.1.1의 온도값에 따라 나와있고, B.1.2에서는 압력값에 따라 나와있다. (2상영역에서는 T와 P가 독립이 아님을 주의). 즉, 포화상태일 때 주어진 온도 (혹은 압력) 하에서, 비체적에 관한 정보를 알 수 있다.
액체-기체의 포화상태의 경우 건도가 중요한 상태량인데, 앞서 말한 건도와 비체적 간의 관계를 통해서 건도를 이용하여 비체적을 구하거나, 반대로 비체적을 이용하여 건도를 구할 수 있다.
◆ 압축(과냉)액체 상태:
온도와 압력이 독립이므로 두 조건이 주어졌을 때 물질의 상을 확정하고 비체적을 구할 수 있다.
◆ 과열증기 상태:
마찬가지로 온도와 압력은 독립이고, 기체만 존재함으로 전체 비체적은 기체의 비체적이다.
포화액체와 포화증기 상태
⊙ 온도가 주어질 때 : Table B.1.1 이용, Data가 압력이 주어질 때 : Table B.1.2 이용
⊙ 하첨자
f : 포화액체의 성질을 의미
g : 포화증기의 성질을 의미
fg : 포화증기상태와 포화액체상태량의 차이
예) vf : 포화액체의 비체적, vg : 포화증기의 비체적, vfg= vg - vf
⊙ hfg : 증발엔탈피 (enthalpy of vaporization) or 증발잠열 (latent heat of vaporization)
⇒ 주어진 온도나 압력하에서 단위 질량의 포화액체를 기화시키는 데 필요한 에너지 양
→ 온도나 압력이 감소할수록 증가하고, 임계점에서 zero가 된다.
⊙ 활용 사례 : 용기 내의 포화액체의 압력, 실린더 내의 포화증기 온도, 증발 과정 동안의 체적과 에너지 변화
◇ 포화액-증기 혼합물 선도
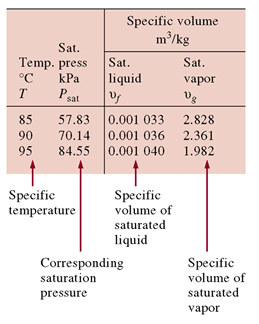
아래 표는 수증기표에서 포화액-증기 상태표의 일부이다.
<표 1> 포화액-증기 상태표의 일부분
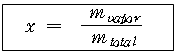
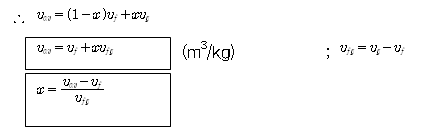
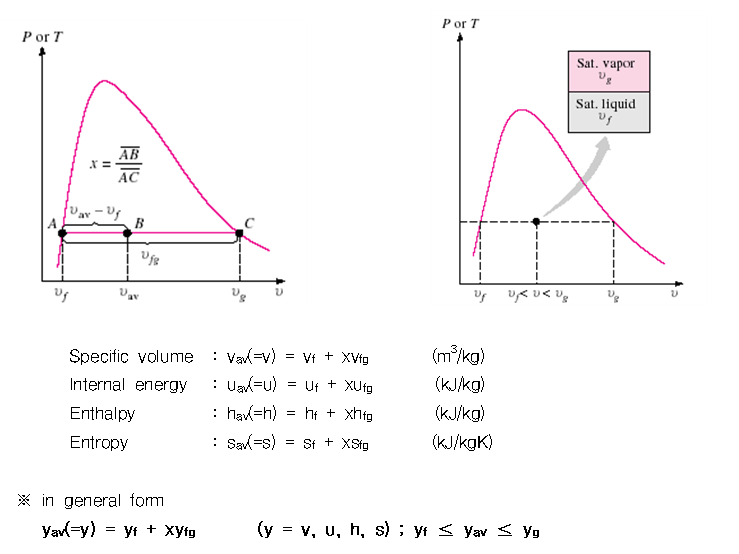
◇ 건도(Quality) :
혼합물 전체 질량에 대한 증기 질량의 비
 |
여기서, |
- 포화혼합물에서 액상과 증기상의 상대적인 양은 건도(quality) x에 의해 정해진다.
1) 포화액 : x=0 or 0%,
2) 포화액-증기 혼합물 : 0<x<1
3) 포화증기 : x=1 or 100%
4) 압축액체영역과 과열증기영역 : 건분의 의미 없음.
- 포화 혼합물에서 건도는 독립된 강성적 성질
- 포화액체의 상태량은 포화액체만 존재하거나 또는 포화증기, 포화혼합물로 존재하거나에 관계없이 같다.
- 포화혼합물은 두 개의 하부계(subsystem)의 조합이나, 편의상 균질의 혼합물로 취급
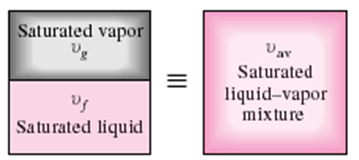
- 포화액-증기 혼합물의 상태량
sat. liquid + sat. vapor = sat. liquid-vapor mixture
volume Vf + Vg = V
mass mf + mg = mt(=m)
quality (1-x) + x = 1
internal energy Uf + Ug = U
enthalpy Hf + Hg = H
entropy Sf + Sg = S
◇ 포화액과 증기가 담겨있는 용기를 고려함
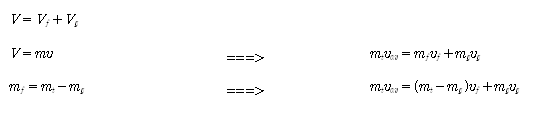 |
 |
과열증기 Superheated vapor
⊙ 과열증기 영역은 증기 만의 단일상 영역
⊙ 과열증기의 특성
(1) lower pressures (P<Psat at given T)
(2) higher temperature (T>Tsat at given P)
(3) higher specific volume (v>vg at given P or T)
(4) higher internal energies (u>ug at given P or T)
(5) higher enthalpy (h>hg at given P or T)
⊙ 아래 표는 수증기표에서 과열증기 상태표의 일부이다.
다음 표로부터 특정압력일 때 온도에 따른 비체적을 알 수 있다.
<표 2> 과열증기 상태표의 일부

압축액체 Compressed liquid
⊙ 압축액 영역은 단일 상 영역(액체상태만 존재)으로 P, T 가 독립적 강성정 성질을 갖는다.
⊙ 압력변화에 따른 상태량 변화가 적다. (압력 100배증가 → 상태량변화는 1% 이하)
⇒ 압력에 가장 큰 영향을 받는 상태량은 enthalpy이다.
⊙ 압축액체에 관한 자료가 없는 경우에는 같은 온도에서의 포화액체의 상태량을 근사적으로 사용한다.
⇒ 압축액체의 상태량은 압력보다는 온도에 의존한다.
◆ Given : P and T ⇒ v ≅ vf@T, u ≅ uf@T , h ≅ hf@T
◆ General form : y ≒ yf at a given temperature (@T)
⊙ 압력이 매우 높은 경우 : h (=h@P,T) ≅ hf@T + vf (P - Psat)
⊙ 압축액체의 특성
(1) higher pressures (P>Psat at given T)
(2) lower temperature (T<Tsat at given P)
(3) lower specific volume (v<vf at given P or T)
(4) lower internal energies (u<uf at given P or T)
(5) lower enthalpy (h<hf at given P or T)
'공학 기술 > 공학기본' 카테고리의 다른 글
| 정압비열 vs. 정적비열 (0) | 2021.12.05 |
|---|---|
| 이상기체 vs. 실제기체 (0) | 2021.12.03 |
| 상변화 과정에 대한 상태량 선도 (0) | 2021.12.01 |
| 순수 물질의 상변화 과정 (0) | 2021.11.30 |
| 순수물질의 상 (0) | 2021.11.30 |






댓글