암모니아(Ammonia)는 질소와 수소로 이루어진 화합물로 분자식은 NH3이다.
무수암모니아 (Anhydrous ammonia)라 함은 기체 또는 액체 상태의 무수암모 니아를 말하며 암모니아가 물에 용해된 암모니아수를 지칭하지는 않는다.

액화 암모니아(Liquefied Ammonia)
액화 암모니아는 상온에서 무색의 심한 악취를 풍기는 물질로 인체에 위험성이 많은 가연성가스로 분류되고 있으나 순수 암모니아 가스 누설로는 불이 잘 붙지 않는다.
한국과 일본 등에서는 가연성가스로 분류하고 있으나 미국 소방법에는 불연성가스로 분류하고 있다.
암모니아의 특성 및 위험요인
(1) 암모니아의 특성은 <표 1>과 같다.
<표 1> 암모니아의 특성

(2) 암모니아 기체는 무색의 강한 냄새를 가지고 있는 물질로, 공기보다 가볍기 때문에 천정이나 높은 곳에 모이는 성질이 있다.
(3) 암모니아는 고압에서 쉽게 액화되고, 대기온도에서 쉽게 기화한다.
(4) 암모니아 액체는 기화하면 약 850배 이상 부피가 팽창하므로 밀폐설비 내에서 압력상 승을 초래한다.
(5) 암모니아 기체는 강한 냄새를 가지고 있으므로 암모니아가 공기 중으로 누출되면 쉽게 감지할 수 있지만, 주기적으로 암모니아 냄새에 노출되는 경우에는 후각이 둔화되어 STEL 노출기준의 약 8배인 300 ppm의 농도에서도 냄새를 맡지 못하는 경우가 있다.
(6) 암모니아의 화재 위험성은 미약하지만, 기름이나 가연성 물질이 존재할 경우 화재위험성이 증가한다.
(7) 암모니아는 염소, 하이포염소산염 표백제 등 강한 산화제와 접촉하면 폭발성 혼합물을 생성할 수 있다.
(8) 암모니아 증기가 수분과 접촉하면 구리, 아연 및 그 합금, 그리고 고무와 플라스틱을 부식시킬 수 있다.
(9) 가압하의 암모니아는 용기가 파괴되는 경우 대부분의 내용물은 증기 또는 미세한 액적(Aerosol)상태로 방출되어 대기로 확산된다.
(10) 암모니아는 일반적으로 공기보다 가벼워 자체 부력으로 확산되나 액체로부터 생성된 암모니아 기체는 공기와 혼합가스를 형성하며 이는 공기보다 무거워 지표면 가까이에 체류할 수 있다.
(11) 암모니아는 구리 또는 구리합금과 강하게 반응한다. 이 반응은 수분이 조금이라도 존재하면 가속화된다.
(12) 암모니아는 수은과 결합하여 폭발성 있는 화합물을 형성하므로 암모니아와 접촉될 가능성이 있는 계기에는 수은을 사용해서는 아니된다.
암모니아의 물리적 특성
<암모니아의 온도별 증기압>
암모니아의 물리적 성질은 부분적으로 수소 결합에 영향을 받는다.
암모니아의 온도별 증기압은 다음과 같다.
<표 2> 암모니아 온도별 증기압력
| 온도(°C) | -33 | 4.7 | 20 | 25.7 | 50.1 |
| 증기압력(atm) | 1 | 5 | 8 | 10 | 20 |
<암모니아의 물에 대한 용해도>
암모니아는 물에 잘 녹는 물질이다. 용액의 어는점에서 암모니아는 질량 %로 약 45%까지 녹을 수 있으며 표준 상태에서 암모니아는 질량 %로 약 30%까지 녹을 수 있다. 용해도는 0 °C의 물에 89.9g/100ml, 20 °C의 물에 52.0g/100ml, 96 °C의 물에 7.4g/100ml이며 20 °C의 에탄올에서의 용해도는 14.8g/100ml이다. 에테르에도 녹는다.
암모니아의 물에 대한 용해는 고온보다는 저온 시 용해도가 높다. 예를 들면 0℃ 때에는 1,176배 용해도를 가지며, 20℃일 때는 702배의 용해도를 갖는다. <표 3>에 주요온도와 압력에 대한 용해도를 제시한다.
<표 3> 가압상태에서의 물에 대한 암모니아 용해도

<액화 암모니아의 증기압 및 밀도>
- NH3 가스 비중 : 0.5962(25℃. 공기=1.) [ 액체 비중은-0.6828Kg/ℓ(-33.7℃)]
- NH3 밀도(Density) : 0.7708g/ℓ(표준상태. 실측치) [이는 공기의 0.5971배에 해당]
* 암모니아 밀도를 이상기체 상태 방정식으로 구하면은 분자량(g)/22.4(ℓ)=0.760g/ℓ이 된다.
→ 따라서 실체 측정치와 이상기체 상태에서는 다소의 차이가 있다.
- NH3 비체적 : 1.297ℓ/g
액화 암모니아는 상온 가압상태에서 쉽게 가스화 되어 수증기 상의 백연(白煙)상태로 변하며 공기보다 가벼워 쉽게 확산하여 증발한다. 암모니아는 액화온도가 -33℃에 불과하여 수소에 비해 액화처리 하는데 있어, 기술적 장벽이 없는 데다가 암모니아는 수소분자를 1.5개 포함하고 있어, 액화 수소 대비 단위 부피당 1.5~2배의 저장용량으로 대용량 저장이 가능하다는 장점이 있는 것으로 알려져 있다.
(1) 액화 암모니아 기화 시 가스의 비체적
액화가스 온도가 0℃, 이때 압력이 0.4232MPa이면 가스의 밀도 는 0.6341Kg/ℓ이 되며, 0℃, 1기압일 경우에는 1.297ℓ/g이 된다.
이를 정리하면 0℃, 1기압에서 액화 암모니아 1ℓ가 기화하면서 갖는 체적은
1ℓ x 0.6341Kg/ℓ x (1.297 x 1000ℓ/Kg)=822.4ℓ ≒ 800ℓ가 된다.
따라서 약 800배의 체적을 갖는다.
(2) 증발열
액체인 물질이 증발할 때 외부로부터 흡수하는 열을 의미한다. 증발열이 크면 증발할 때 주변의 열을 더 많이 흡수한다. 액체 상태인 분자들은 기체 상태보다 결합이 많이 되어 있는데 이 결합을 끊기 위해 열을 흡수하는 것이다.
이와 반대로 기체인 물질이 액체로 될 때는 같은 양의 열을 방출한다. 증발열의 예로는 여름에 물을 뿌리면 시원함을 느끼는 것 등이 있다.
<표 4> 액화 암모니아의 온도별 증발열

암모니아 화학적 성질
암모니아가 관여된 대부분의 반응은 크게 암모니아 첨가 반응, 암모니아 치환 반응, 산화·환원 반응으로 나눌 수 있다.
<암모니아 첨가 반응>
가장 대표적인 것으로 암모니아와 물이 반응하여 암모니아수를 생성하는 반응을 들 수 있다.
암모니아는 강산과 반응하여 암모늄염을 생성한다. 반응식은 다음과 같다.
4NH3 +HX ⟶ NH4+ +X−
* 황산과의 반응
2NH3 + H2SO4 → (NH4)2SO4 (황산암모니아)
<암모니아 치환 반응>
반응의 대표적인 예는 클로로벤젠과 암모니아가 반응하여 아닐린을 생성하는 것이 있다.
C6H5Cl + 2NH3 → C6H5NH2 + NH4Cl
<산화·환원 반응>
암모니아의 산화·환원 반응은 암모니아에 포함된 질소의 산화 상태가 바뀌는 반응과 수소가 해리되는 반응으로 나눌 수 있다.
전자의 예로는 다음과 같이 백금 촉매의 존재 하에 암모니아가 일산화 질소로 산화되는 반응을 들 수 있다.
4NH3 +5O2 ⟶ 4NO +6H2O
촉매가 존재하지 않는다면 암모니아는 산소로 인하여 연소되어 질소와 물을 내놓는다. 이 과정에서 소량의 질산 암모늄, 이산화 질소 등이 생성되기도 한다.
4NH3 +3O2 ⟶ 2N2 +6H2O
암모니아는 할로젠과 반응하여 산화되어 질소를 내놓고, 생성된 할로젠화 수소는 다시 암모니아와 결합하여 염을 만든다. 암모니아가 염소로 산화될 경우의 반응식은 다음과 같다.
2NH3 +3Cl2 ⟶ 2N2 +6HCl
HCl +NH3 ⟶ NH4Cl
앞의 반응에서 염소가 과잉으로 있다면 다음과 같은 반응이 추가적으로 진행되어 폭발성의 황색 기름인 삼염화 질소가 생성된다.
NH4Cl +3Cl2 ⟶ NCl3 +4HCl
용매로서의 특성
액체 암모니아는 특정 화학 반응에서의 용매로 사용할 수 있다.
용매로서의 암모니아는 그 성질이 물과 에탄올의 중간에 해당한다. 예를 들어, 이온성 물질을 녹이는 능력은 물, 암모니아, 에탄올 순으로 좋다. 반면에, 공유 결합성 물질을 녹이는 능력은 암모니아가 물보다 뛰어나다. 물과 마찬가지로, 암모니아 역시 자동 이온화될 수 있으나, 그 비율은 물에 비해서 현저하게 낮다. 반응식은 다음과 같다.
2NH3 ⇄ NH4+ +NH2−
[NH4+][NH2−]=1⋅9×10^−33 (-50°C)
액체 암모니아에 알칼리 금속, 알칼리 토금속 등을 녹이면 농도가 낮을 경우 용액이 청색을 띠고, 농도가 높을 경우 청동색을 띠게 된다. 알칼리 금속의 경우 10~20몰랄농도까지도 녹을 수 있다. 금속을 액체 암모니아에 녹일 경우 다음과 같은 평형 반응이 진행되어 전자가 금속으로부터 떨어져 나와 암모니아 분자로 둘러싸인 용매화 전자가 생성된다.
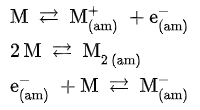
반응식에서 아래 첨자 (am)은 분자가 암모니아 분자로 둘러싸여 용매화된 상태를 나타낸다. 이러한 상태에 있는 용액은 불안정하지만, 촉매가 없는 한 다음과 같은 반응이 매우 느리게 진행되어 금속 아마이드와 수소 기체를 형성한다.
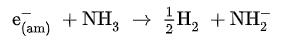
용매화 전자가 존재하는 용액은 강력한 환원제로 작용할 수 있고, 따라서 암모니아에 금속이 녹은 용액은 암모니아에 녹는 유기 화합물의 환원 반응을 진행시키는 데 적합하다.
암모니아는 물에 비해서 양성자를 잘 내놓지 않는 반면 전자는 더 잘 취한다. 따라서 액체 암모니아는 NH2-, C2H5O- 등의 강한 염기성 물질이나 용매화 전자와 같은 강한 환원제를 다루는 데 적합하다. 그러나 산성 물질이나 산화제를 다룰 때는 물을 용매로 하는 것이 더 적합하다.
Reference : 1. 가스신문(http://www.gasnews.com)
2. KOSHA GUIDE D - 34 - 2013 무수암모니아 저장에 관한 기술지침
3. https://ko.wikipedia.org/wiki/%EC%95%94%EB%AA%A8%EB%8B%88%EC%95%84
'화학물질관리 > 화학물질' 카테고리의 다른 글
| 유해화학물질의 표시대상 및 방법 (0) | 2023.11.12 |
|---|---|
| 암모니아 안정성 (0) | 2023.10.16 |
| 암모니아 수용액 (0) | 2023.10.16 |
| 무수불산(HF) (0) | 2023.10.16 |
| 염화수소(무수/HCl) (1) | 2023.10.15 |





댓글