화학반응식은 원자 단위를 기본으로 세우지만 실제로 원자 단위의 양은 너무 미세하여 실험실이나 공정에서 다루는 것이 불가능하다. 따라서 반응물과 생성물을 g 또는 kg 등의 단위로 다루기 위해 몰 단위를 사용하여야 한다.
또한 화학 반응에서 산과 같은 반응물을 첨가할 때에는 적정 농도로 반응을 시키는 것이 일반적이다. 이 때 사용되는 농도가 몰 농도(Molarity), 몰랄 농도(Molality) 및 노르말 농도(Normality)이다.

몰(Mole) 과 농도(Concentration) 관계
몰(Mole)은 원자 또는 분자를 6×10^23개 모아 원자질량단위를 g으로 승격시킨 물질의 양 단위로 g몰(g-mole), kg몰(kg-mole), lb몰(lb-mole) 등의 단위를 사용한다
화학 공정에서 유입되거나 유출되는 물질은 대부분이 혼합물이다. 공정의 양론 계산을 하기 위해서는 이러한 혼합물들에 각각의 성분들이 얼마만큼씩 존재하는지 계산하는 것이 필요하다. 바로 혼합물 중에 들어있는 각각의 성분의 양을 알기 쉽게 표시한 것을 농도(Concentration)라 한다.
혼합물을 구성하는 요소는 용매(solvent)와 용질(solute)이다. 용매와 용질이 섞여 있는 상태를 용액(solution)이라 하며 용액은 우리가 잘 알고 있는 액체 용액뿐만 아니라 공기(질소와 산소)와 같은 기체 용액도 존재한다. 용액 상태의 혼합물 중 일반적으로 양이 많은 것을 용매라 하고 용액 중에 소량으로 섞여 있는 물질을 용질이라 한다. 지구 상에서 가장 널리 이용되는 용매는 물이며 벤젠과 같이 물에 용해되지 않는 비극성 물질의 경우에는 사염화탄소 등과 같은 비극성 용매를 사용한다.
화학 반응에서 산과 같은 반응물을 첨가할 때에는 적정 농도로 반응을 시키는 것이 일반적이다. 이 때 사용되는 농도가 몰 농도(Molarity), 몰랄 농도(Molality) 및 노르말 농도(Normality)이다.
몰농도(Molarity)와 몰랄 농도(Molality)는 둘 다 몰수를 나타내는 점에서는 같지만 몰랄 농도는 질량을 기준으로 하고, 몰 농도는 부피를 기준으로 하는 점이 다르다. 따라서 몰랄 농도는 온도 변화에 영향을 받지 않고 용액의 농도에 따른 증기압력 내림, 어는점 내림 또는 끓는점 오름, 삼투압 측정 등에 사용한다.
1) 몰 농도(Molarity 또는 Molar concentration)
몰 농도는 용액 1리터 속에 녹아 있는 용질의 양으로 정의되며 단위는 ㏖/L 또는 M으로 나타낸다.

여기서, n은 용질의 양(몰의 수), N는 부피 V에 들어 있는 분자의 수, N/V 비는 수(數)밀도 C, 그리고 NA는 아보가드로 수, 약 6×10^23/ ㏖., 또는 좀 더 간단하게,
1 molar = 1 M = 1 ㏖/L이다.
몰 농도는 화학에서 주어진 단위 체적 내에서, 용액 속의 용질의 농도 또는 분자나 이온 그리고 원자 종의 농도의 척도가 된다.
몰농도는 용액 L 당 특정 물질의 몰수를 알기 쉽기 때문에 시약 관련 산염기 적정 등 반응식을 계산 등에 많이 사용되고 있다.
그러나, 가끔 열역학 측면에서 몰농도의 사용은 아주 알맞은 것은 아니다. 왜냐하면 대부분의 용액의 부피는 온도 때문에 열팽창의 영향을 어느 정도 받기 때문이다. 이 문제는 흔히 온도 보정 인자를 도입하거나, 또는 몰랄 농도(molality)와 같은 온도와 무관한 척도를 사용함으로써 해결한다.
2) 몰랄 농도(Molality)
몰랄 농도는 용매 1kg에 녹아 있는 용질의 몰수로 정의되며 단위는 ㏖/㎏ 또는 m으로 나타낸다.
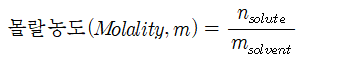
여기서, nsolute은 용질의 양(몰의 수), msolvent는 용매의 질량, 또는 좀 더 간단하게,
1 molal = 1 m = 1 ㏖/kg이다.
온도에 따라 부피가 변하면 농도도 따라서 변하므로 불편할 때가 있어, 끓는점 오름이나 어는점 내림 따위를 측정할 때는 몰랄 농도를 사용한다.
3) 노르말 농도(Normality 또는 Equivalent Concentration)
노르말 농도는 용액 1 리터 당 용질 당량 무게의 수로 정의되며 단위는 N으로 나타낸다.
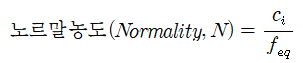
여기서, ci는 몰 농도(molar concentration), feq는 당량(equivalence factor), 또는 좀 더 간단하게,
1 N = 1 eq/L = (용질 당량수, eq)/(용액의 부피, L)이다.

노르말 농도는 염의 화학적 성질을 강조하는 농도 개념이다. 그러나 이 노르말 농도는 구하려는 당량(equivalence factors)값이 반응 환경에 따라 각기 다르게 산출되는 모호성 때문에 관련 기관에서 사용을 권장하지 않는다.
Reference : wikipedia.org
'공학 기술 > 공학기본' 카테고리의 다른 글
| 이상 기체 상태 방정식 (0) | 2021.02.20 |
|---|---|
| 온도(Temperature)와 압력(Pressure) (0) | 2021.02.02 |
| 일, 에너지, 일률(동력) 개념 (0) | 2021.02.02 |
| 질량(Mass) vs. 중량(Weight) (0) | 2021.01.26 |
| 절대(질량)단위 vs. 공학(중력)단위 (0) | 2021.01.21 |





댓글