밀도는 단위 부피당 존재하는 물질의 질량이다. 즉, 밀도는 물질의 부피와 질량 사이의 관계를 보여준다.

공기의 밀도
일반적으로 밀도는 기체, 액체, 고체로 갈수록 커진다. 물은 액체고, 공기는 기체 혼합물이니 당연히 물보다는 공기의 밀도가 작을 것으로 예상할 수 있다.
4 ℃ 물의 밀도는 1 [g/mL] (= 10^3 [kg/㎥])다. 부피 실린더로 1 [mL] 부피를 정확하게 재어 저울에 올려놓으면, 저울 눈금이 정확히 1 [g]을 가리킨다는 뜻이다. 이와 같이 밀도는 물질의 부피와 질량 사이의 관계를 보여준다.
공기의 밀도는 문헌에서 15 ℃ 조건에서 약 1.225 [kg/m3] 정도라 한다.
물의 밀도가 1000 일 때, 공기는 1.225 다. 약 816 배 정도 물의 밀도가 크다.
공기의 밀도 계산
공기는 질소와 산소, 그리고 미량의 여러 기체가 섞인 혼합물이다. 고도와 지역에 따라 그 비율이 조금씩 다르겠지만, 대체로 질소(N2) 78 %, 산소(O2) 21 %, 그 밖의 기체 1 %(아르곤 0.9 % 외) 로 이루어졌다 말한다. 여기서의 비율은 부피 퍼센트(%, v/v)다.
<표 1> Composition of dry atmosphere, by volume
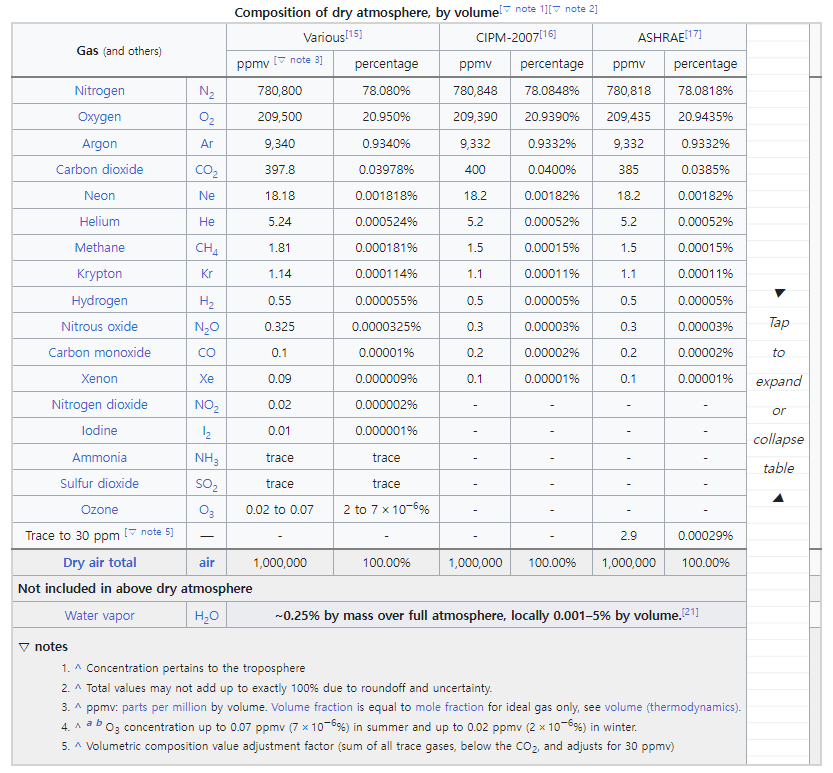
아보가드로 법칙에 따르면, 일정 온도와 압력 조건에서 기체의 부피는 입자수와 비례한다. 우리는 공기의 부피 퍼센트를 알고 있다. 총 100 개의 공기 입자(가정)가 있다면, 그 중 78 개는 질소, 21 개는 산소, 아르곤 1개라는 뜻이다.
또한 0 ℃, 1 기압 조건에서 모든 기체 1 몰의 부피는 22.4 L이다.
온도 조건이 바뀌어 25 ℃, 1 기압 조건에서 기체 1 몰의 부피는 약 24.5 L 이다.
위의 부피 퍼센트에 따라 24.5 L 공기 1 몰 중 0.78 몰은 질소, 0.21 몰은 산소, 0.01 몰은 아르곤 기체다.
성분 기체의 몰질량 [g/mol]과 몰수 [mol]를 이용하여 해당 기체 혼합물의 질량을 구할 수 있다.
* 25 ℃, 24.5 L 에 포함된 공기(질소, 산소, 아르곤)의 질량 [g]
1) 질소기체(N2)의 질량 [g] = 0.78 [mol] * 28 [g/mol] = 21.84 [g]
2) 산소 기체(O2)의 질량 [g] = 0.21 [mol] * 32 [g/mol] = 6.72 [g]
3) 아르곤 기체(Ar)의 질량 [g] = 0.01 [mol] * 40 [g/mol] = 0.4 [g]
∴ 공기의 질량 [g] = 21.84 + 6.72 + 0.4 = 28.96 [g]
즉, 25 ℃, 24. 5 L의 부피 해당하는 공기의 질량은 28.96 [g]이다.
따라서 이를 밀도로 나타내면, 1.18 [g/L]이다.
공기의 밀도 [g/L] = 28.96 / 24.5 = 1.18 [g/L] (25 ℃, 1기압 조건)
Reference : https://stachemi.tistory.com/208
'공학 기술 > 공학기본' 카테고리의 다른 글
| 가스 또는 증기의 상대밀도 (0) | 2023.07.20 |
|---|---|
| 가스 밀도(Gas Density) (0) | 2023.07.20 |
| 분자량, 몰 질량 등 (0) | 2023.05.31 |
| 이상 기체 관련 공식 (0) | 2023.05.29 |
| Propane 비열(Specific Heat) (0) | 2023.05.29 |





댓글