이상 기체(Ideal gas or Perfect gas)란 분자 사이의 거리가 그 크기에 비해 매우 커서 분자 사이의 인력이나 분자 크기의 영향을 무시할 수 있는 기체로 보일- 샤를(Boyle-Charles)의 법칙을 따르는 기체를 말한다.

이상 기체 관련 공식
실제 기체는 이상기체가 아니며, 압력을 어느 정도 낮추면 기체를 구성하고 있는 분자 사이의 거리가 증가하여 이상 기체의 상태로 된다.
실용적으로 특별한 고압이나 저온이 아닌 산소, 질소, 공기, 연소 가스 등의 기체는 이상 기체로 취급할 수 있다.
보일- 샤를(Boyle-Charles)의 법칙
● 보일의 법칙(Boyle's law)은 용기의 부피가 감소할 때 용기 내 기체의 압력이 증가하는 경향을 나타내는 실험 법칙이다.(등온 과정)
- 온도와 기체의 양이 일정한 닫힌 계 내에서 일정한 질량의 이상 기체가 가하는 절대압력은 그것이 차지하고 있는 부피에 반비례한다.
(1) P∝1/V
(2) PV = k
(P : 기체의 압력, V : 기체의 부피, k : 상수)
- 비례 상수 k는 기체의 종류와 온도에 따라 다르며, 이러한 조건들이 고정되면 k의 값도 일정하다.
- 이 방정식은 밀폐된 공간에서 온도가 일정할 때 일정한 질량의 기체에 대해 압력과 부피의 곱은 상수라는 의미다. 따라서 같은 조건에서 압력과 부피의 변화가 있다면 아래와 같이 표현할 수 있다.
P1V1 = P2V2
● 샤를의 법칙(Charles's law)은 이상 기체의 성질에 관한 법칙이다.
(등압 과정)
- 샤를의 법칙은 이상 기체의 압력이 일정한 상태에서 V가 기체의 부피, T가 기체의 절대 온도, k가 상수값이라 할 때 다음 식이 성립한다는 것이다.
(1) V∝T
(2) V/T = k
(V : 기체의 부피, T : 기체의 열역학적 온도, k ; 비례상수)
- 이 법칙은 온도가 올라감에 따라 기체가 어떻게 팽창하는지를 설명한다. 반대로, 온도가 내려가면 부피가 감소한다. 2가지 다른 조건에서 동일한 물질을 비교하기 위해 이 법칙은 다음과 같이 쓸 수 있다.
V1T2 = V2T1
● 보일- 샤를(Boyle-Charles)의 법칙
(이상기체 관계식)
- 이상 기체의 압력과 부피의 곱은 온도에 비례
(1) PV/T = k (k=const)
(2) P1V1/T1 = P2V2/T2 = k
아보가드로(Avogadro) 법칙
(일정 온도, 압력에서 입자 수와 관련된 공식)
- 기체의 온도와 압력이 일정하면, 기체 부피 안의 입자 수의 비율은 일정
● 표준 상태(0 ℃, 1atm)에서 모든 기체 1mol의 체적은 22.4 ℓ 이다.
1mol = 22.4 ℓ = 22.4 x 10^-3 ㎥
1kmol = 22.4 ㎥
● NA = Avogadro Number = 6.022 x 10^23 [1/mol]
이상기체 상태방정식(The ideal gas equation of state)
● P V = n R T = m R T
| 1 | P V = n R T = N kB T |
P ; 절대 압력 (Pa) V ; 부피 (㎥) T ; 절대 온도 (K) n = m / M ; 기체의 몰수 (mol) R ; 보편기체상수 (universal gas constant, 8.314J/mol·K) ☞ 기체의 화학적 종류에 무관 N ; 입자 수(NA ; 아보가드로 수) kB = R/NA (볼츠만 상수, 1.38x10^-23 J/K) m ; 분자량 M ; 몰 질량 (g/mol) |
| 2 | P V = m R T | R = R / M ;개별기체 상수 (specific gas constant, kJ/kg·K) |
● 이상기체 상태방정식의 다른 표현
P = (n R T) / V = (n M / V) (R / M) T
☞ 이상기체의 밀도가 변하면 이상기체의 압력도 변하게 됨
| 1 | P = ρ R T = (n / V) R T |
R = R / M ; 개별 기체상수(individual gas constant) ☞ 기체의 종 마다 달라지는 기체상수 M ; 몰 질량 ρ = n M / V ; 질량 밀도 n = m / M ; 기체의 몰수 V ; 부피 |
| 2 | P = C R T | C = n / V ; 몰 농도(기체의 단위 체적 당 몰 수) |
* 분자랸, 몰 질량, 몰 농도, 몰수 등에 대한 것은 다음 포스팅 링크 자료 참조
https://sec-9070.tistory.com/1070
분자량, 몰 질량 등
화학량론 및 열역학 등에서 사용되고 있는 화학식량(Formula weight), 분자량(Molecular weight), 원자량(Relative atomic mass / Relative atomic weight), 몰 질량(Molar mass), 몰 농도(molarity 또는 Molar concentration) 등에 대
sec-9070.tistory.com
기체상수 (gas constant)
기체상수에는 다음과 같은 두 가지 종류가 있다.(universal gas constant vs. individual gas constant)
● 보편기체상수 (gas constant, molar gas constant, universal gas constant, or ideal gas constant)
- 이상 기체 상수(R)는 이상 기체 법칙에 나타나며 특정 기체에 대한 개별 기체 상수(R)와 기체의 몰 질량(M) 사이의 곱으로 표현할 수 있으며, 모든 이상 기체(Ideal gas or Perfect gas)에 대해 동일하다.
| 보편기체상수 (gas constant, molar gas constant, universal gas constant, or ideal gas constant) |
R |
|
* 보편기체상수 환산 예시

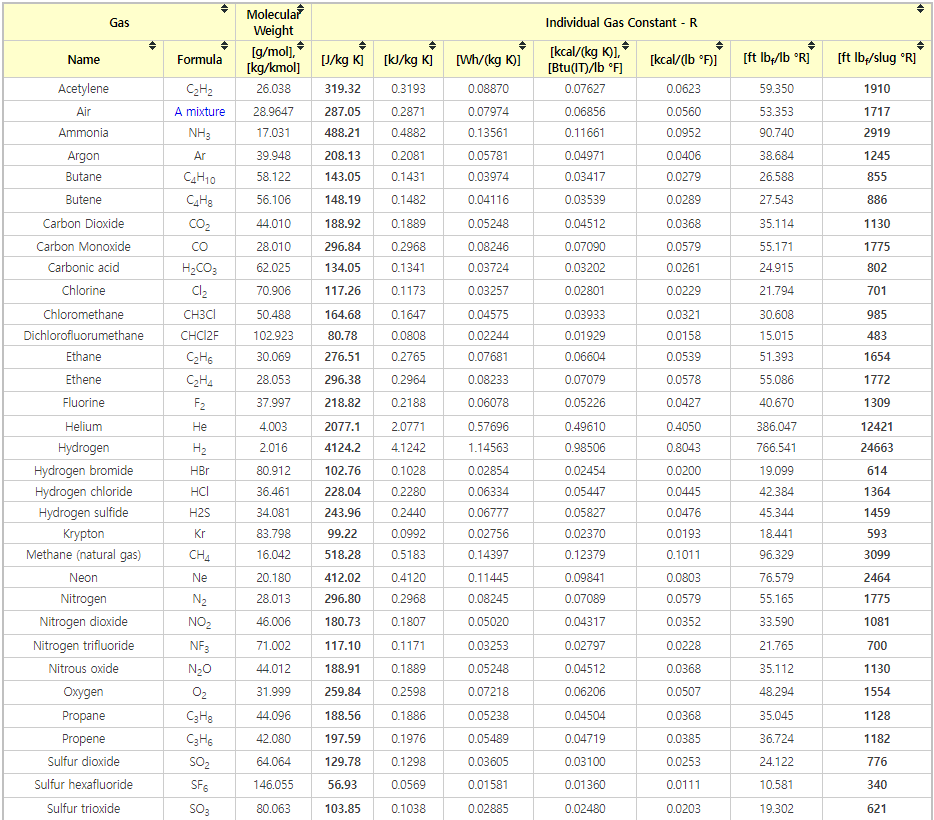
● 개별기체상수(specific gas constant or individual gas constant)
- 개별 기체 상수는 다음 표와 같이 특정 기체에 따라 다르며 기체의 분자량과 관련이 있다. 이 값은 온도와 무관하다.
기체의 개별 기체 상수 R은 이상기체 상수 R과 기체 몰 질량(M, Molar mass)으로부터 계산할 수 있다:
R = R / M
Imperial System에서 개별 기체 상수의 가장 일반적인 단위는 ft lbf/lb ºR이다. SI System에서 가장 일반적인 단위는 J/kg K이다.
<표 1> The Individual Gas Constant for gases:
이상 기체의 비열비(Ratio of specific heat)
* 정적 비열; Cv , 정압비열; Cp, 비열비; κ = Cp/Cv
| h = u + Pv = u + RT dh = du + RdT = Cv dT + RdT CpdT = CvdT + RdT |
∴ R = Cp - Cv |
| R/Cv = Cp/Cv - 1 = κ - 1 | ∴ Cv = 1/(κ-1)*R |
| R/Cp = 1- (Cv/Cp) = (κ-1)/κ | ∴ Cp = k/(κ-1)*R |
| * SI unit : 여기서 Cp 와 Cv 의 단위는 (KJ/kg×K) | R :개별기체상수 * 상기 표 1 참조 |
κ (kappa) = Cp/Cv > 1 ( Cp > Cv )
※ Cp > Cv 인 이유 : 물질의 온도를 1℃ 상승시키는데 정압과정에서는 압력을 일정하게 유지시키기위해 부피를 팽창시키는데 에너지가 사용 되었으므로 더 많은 열량이 소요된다..
Reference : https://www.engineeringtoolbox.com/individual-universal-gas-constant-d_588.html
'공학 기술 > 공학기본' 카테고리의 다른 글
| 공기의 밀도 (0) | 2023.07.19 |
|---|---|
| 분자량, 몰 질량 등 (0) | 2023.05.31 |
| Propane 비열(Specific Heat) (0) | 2023.05.29 |
| 분진폭발 특징 및 발생조건 등 (0) | 2023.03.09 |
| 연소시 이상(異常)현상 (0) | 2023.03.04 |





댓글