염산(鹽酸, hydrochloric acid, muriatic acid)은 염화 수소(HCl) 수용액이다. 염화수소산(鹽化水素酸), 염강수(鹽強水)라고도 하며, 대표적인 강산이다. 강산이기 때문에 물을 넣어 많이 희석한 '묽은 염산'이 많이 이용된다.

염산의 위험성
염산 vs. 염화수소
염산(Hydrochloric acid)
- 염화수소산 이라고도 하며, 염화수소 수용액으로 무색의 강산으로 부식성이 강하다.
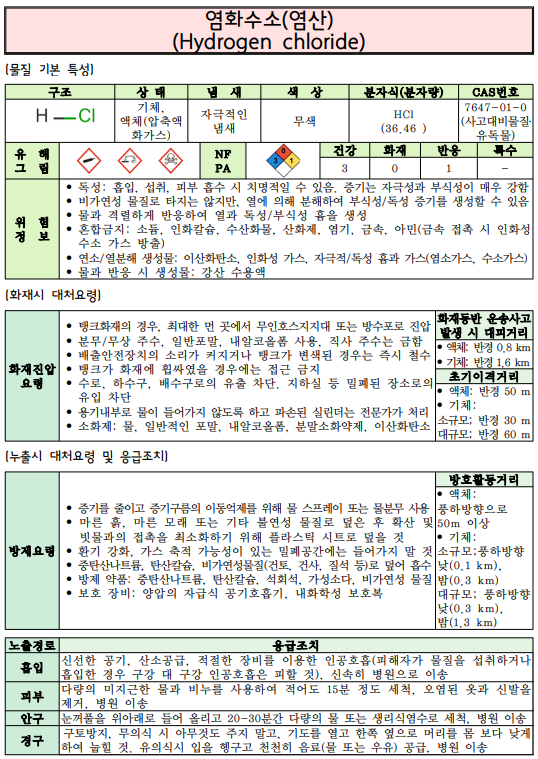
염화수소(Hydrogen chloride)
- 상온, 상압에서 무색이며 자극적인 냄새가 나는 유독한 기체이다.
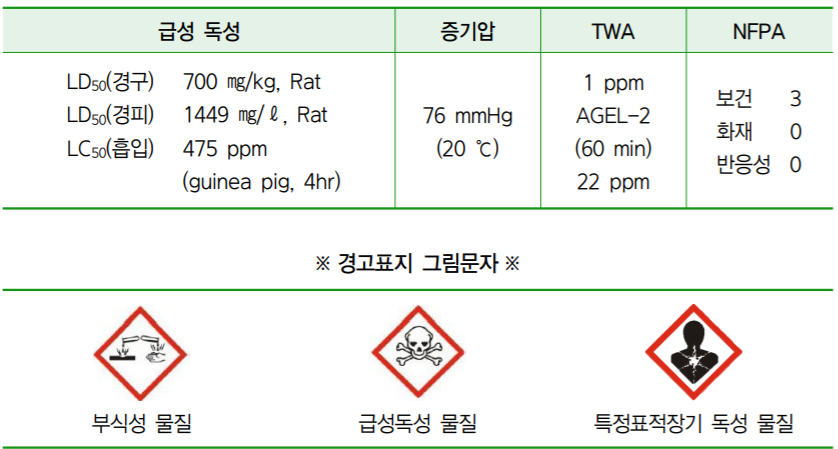
※ 염화수소의 노출기준은 산업안전보건법상 TWA는 1 ppm, STEL은 2 ppm이며, IDHL (생명에 즉시 위험한 농도)는 50 ppm으로 규정
<표 1> 염산과 염화수소의 일반적인 성질

순수한 HCl은 염화수소라고 부르는 푸르스름한 색의 기체이다. 하지만 주변에 물이 있으면 엄청난 속도로 용해되어 염산 수용액이 된다.
따라서, 실험 중에 생성되는 기체 염산을 들이마신다면 기체 염산은 호흡기 조직 내의 수분과 결합하여
폐 조직을 녹여버린다. 소량일 경우라도 폐 점막에 심각한 손상을 끼칠 수 있고, 다량일 경우 폐부종으로 인한
호흡곤란 등으로 사망에 이를 수 있다.
따라서 실험할 때에는 후드 안에서만 취급하여야 한다. 후드 내부에서 작업 시에도 반드시 도어를 내리고, 환기를 켠 상태에서 진행해야 한다. 만약 염산 증기를 흡입하는 사고가 발생했다면 즉시 깨끗한 공기를 마시게 하고 신속히 병원으로 옮겨 의사의 진료를 받아야 한다.
염산의 물리·화학적 성질
염산은 염화 수소의 농도에 따라 수소 이온 농도 지수, 점성, 비열, 증기압, 끓는점, 녹는점 같은 물리적 성질이 달라진다.

위 표는 10% 부터 38% 까지의 염화 수소의 농도에 따른 물리적 성질을 보여준다.
염산, 즉 HCl과 H2O의 이성분 화합물은 염화 수소의 농도가 20.2% 이고 108.6 °C (227 °F) 일 때 불변 끓음 혼합물이다.
염산에는 4가지의 결정화 공정점이 있다.

그리고 얼음 (0% HCl)이다. 그리고 준안정 공정점이 있으며 이것은

와 얼음의 중간형태를 띠며 염산의 농도는 24.8%이다.
다음 그림은 온도에 따라 염화 수소가 물에 녹는 정도를 나타내는 Diagram이다.

염산은 주로 38%의 포화 농도의 염산을 생성하고 사용한다. 40% 또는 그 이상의 농도도 가능하지만, 증발이 심하게 많아서, 이 고농도의 염산은 고압 또는 저온상태에서 주로 생성되고, 팔린다. 대량 생산 또는 산업적 생산으로는 보관하거나, 이용하기 쉬운 30~34%의 염산을 주로 사용한다.
염산의 안정성 및 반응성
- 반응성 : 물과 접촉하면 발열반응을 할 수도 있다.
- 피해야 할 조건 : 반응성 물질(물 등)과 접촉을 최소화 하여야 하며, 밀폐용기에 보관 시 열에 노출되면 폭발을 야기할 수 있다.
- 혼합금지 물질 : 소듐, 인화칼슘, 수산화물, 산화제, 염기, 금속, 아민 (금속 접촉 시 인화성 수소 가스 발생)
- 열분해로 염소가 생성된다.
- 중합 반응은 일어나지 않는다.
강산으로서의 성질
염화 수소는 일양성자 산이다. 염화 수소의 수용액에서는 염화 수소에서 수소 이온이 빠져나와서 물에 결합해 H3O+를 만든다.

다른 이온은 Cl- 으로 이것은 염화 나트륨과 같은 염화 이온을 만들 때 쓰일 수 있다. 염산은 강산인데, 물에 거의 완전히 용해되기 때문이다. 일양성자 산에서는 산의 이온화 상수 인 Ka가 하나뿐이다. 이것은 물에 산이 해리되는 정도를 나타낸다. 염산처럼 강산은 이온화 상수가 높다. 염화 나트륨 같은 염화물에 들어있는 염화 이온은 수소 이온 농도 지수에 거의 영향을 주지 않는다. 염산이 강산이라서 그 짝염기인 염화 이온은 염기성을 거의 띠지 않는다.
금속의 부식
염산은 금속을 부식시키는 데에 쓰이기도 한다. 예를 들어 아연과 염산이 반응하면 다음과 같은 반응이 일어나면서 아연은 염화 이온 즉, 염화아연이 된다. 이는 이온화 경향에 따라 일어나는 화학 반응이므로, 수소보다 이온화 경향이 낮은 금속은 염산에 부식되지 않는다. 즉, 금, 은 등은 염산에 부식되지 않는다.

염산 유해·위험성
염산의 유해성
고농도의 염산은 다량의 증기가 발생하며 이는 눈, 피부, 창자 등의 생체 조직에 손상을 입힐 수 있다. 또 염산을 과망가니즈산 칼륨이나 차아염소산나트륨 등에 섞으면 유독한 염소 기체가 생성된다.

| 농도 | 분류 | R-phrase(유럽 연합 위험 규정) |
| 10–25% | 자극물 (Xi) | R36/37/38(눈, 호흡기, 피부) |
| > 25% | 부식성 물질 (C) | R34(화상): R37(호흡기) |
염산 자체가 폭발하지는 않으나 염산에서 생성된 수소는 폭발할 수 있다. 이온화 경향이 큰 알칼리 금속이나 알칼리 토금속과 염산이 반응하면 금속이 부식해서 다음과 같은 반응이 일어난다.

이온화 경향이 큰 칼륨, 칼슘, 나트륨 등의 금속과 반응하면 수소기체가 많이 발생하고 온도가 높은 상황에는 폭발할 수도 있다.
염산, Hydrochloric Acid 35 % (Cas No. 7647-01-0) 정보 요약
화학사고 대응방법
Reference : 화학물질안전원, 염산 취급시설 안전관리 안내서
https://ko.wikipedia.org/wiki/
'화학물질관리 > 화학물질' 카테고리의 다른 글
| 제한물질·금지물질의 지정 (0) | 2021.09.10 |
|---|---|
| MSDS 건강 유해성 정보 (0) | 2021.08.26 |
| 황산의 위험성 (0) | 2021.08.17 |
| MSDS 작성 대상 (0) | 2021.07.19 |
| MSDS 관련 용어 정의 (0) | 2021.07.19 |





댓글