백만분율은 수를 1,000,000과의 비로 나타내는 방법으로, ppm(parts per million)이라는 기호를 사용한다. ppm은 백만분의 1이라는 뜻이며, 고체시료의 농도를 나타낼 경우 용액 1 kg에 들어있는 용질의 mg 수(또는 mg/kg)를 나타내며, 액체 시료의 경우 용액의 밀도가 대부분 1kg/L라고 하며 1L에 들어있는 용질의 mg 수를 나타내기도 한다.
ppm값을 10,000으로 나누면 %(백분율)로 단위를 변환할 수 있다. 주로 대기나 해수, 지각 등에 존재하는 미량 성분의 농도를 나타낼 때 사용된다.

ppm 사용 방법
공기(air)에서의 부피 또는 몰 단위의 ppm
기체에 적용된 대기 오염 문헌에서 ppm은 항상 부피(volume) 또는 몰(mole) 단위로 백만분의 1을 의미한다. 이것들은 이상 가스로 가정하며, 사실상 1atm의 대기 오염 관심의 대부분의 가스와 동일하다.
이 값을 달리 ppmv로 표현하기도 한다.
1 ppmv는 다음 식으로 표현할 수 있다.

기체 농도를 µg/㎥ 단위로 표현하는 것은 미터법 표현에 장점이 있지만 온도와 압력의 변화에 큰 영향을 받는다는 단점이 있다. 게다가, 분자량의 차이 때문에, 다른 기체의 농도의 비교는 어렵다.
ppmv를 µg/㎥와 같은 메트릭 표현식으로 변환하려면 관련 가스의 밀도에 대한 정보가 필요하다. 가스의 밀도는 아보가드로 법칙(Law of Avogadro's)에 의해 계산될 수 있는데, 아보가드로 법칙은 같은 온도와 압력에서 가스의 종류에 상관없이 같은 양의 가스는 같은 수의 분자를 포함하고 있다고 말한다.
이 법칙은 STP에서 1몰의 가스가 22.71108리터(d㎥)의 부피를 점유하는 것을 의미하며, 또한 이상 가스의 molar volume으로도 언급된다.
표준 온도 및 압력(STP)은 IUPAC의 표준인 100.00 kPa(1bar)와 273.15 K(0°C)의 조건으로 정의된다. 해당 가스의 몰의 양은 분자량(molecular weight)으로 계산할 수 있다.


다른 온도 및 압력 조건에서의 미터법 차원의 다른 농도로 계산하기 위해서는 이상 기체 법칙이 유용하게 사용된다.
이상기체법칙으로부터 다음과 같은 식이 유도된다.
분자의 수(n)로 나눈 부피(V)는 온도(T)와 압력(P)을 가진 가스의 molar 부피(Vn)를 나타낸다.
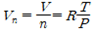

상기 식을 이용하여 여러 온도 및 압력 하에서의 농도를 산출할 수 있다.
물(water)에서의 중량 단위의 ppm
물속 가스의 ppm 농도는 중량(weight)에 의해 결정된다. 이 농도를 미터법으로 표현하려면 물의 밀도(density)가 필요하다
순수 물의 밀도는 1969년까지 3.98°C의 온도와 표준 대기 압력에서 정의상 1,000 kg/㎥이어야 한다. 그때까지 이것은 kg에 대한 비열한 정의였다. 오늘날의 kg은 kg의 국제 프로토타입의 질량과 같은 것으로 정의된다.
4°C(IPTS-68)의 온도와 표준 대기압에서 고순도(VSMOW) 물은 999.9750 kg/㎥의 밀도를 가진다.
물의 밀도는 온도, 압력, 불순물, 즉 용존 가스 또는 물의 염도에 의해 영향을 받는다. 심지어 물에 용해된 가스의 농도에 관한 것조차도 용액의 밀도에 영향을 미치고 있다. 자연적으로 물은 물의 밀도에 영향을 미치는 중수소의 특정 농도를 포함할 가능성이 있다. 이 농도는 동위원소 구성(isotopic composition)이라고도 한다.
이러한 변환에 대한 정확한 계산은 물의 밀도를 측정할 때만 가능하다. 따라서 실제로 물의 밀도는 1,000 kg/㎥으로 설정된다. 이 값으로 변환을 계산할 때 얻을 수 있는 것은 다음과 같다.

여기서 ρw = 물의 밀도 [1,000 kg/㎥]
Reference : https://www.lenntech.com/calculators/ppm/converter-parts-per-million.htm
'공학 기술 > 공학기본' 카테고리의 다른 글
| 환기의 표준조건 (0) | 2021.06.13 |
|---|---|
| 에너지열량 환산기준 (0) | 2021.06.02 |
| 송풍기 압력 변화 (0) | 2021.04.14 |
| 표준상태조건, 표준조건(STP), 정상조건(NTP), SATP, ISA 요약 (0) | 2021.04.02 |
| 금속 열처리 종류 (0) | 2021.03.18 |





댓글