연소란 빛과 열을 수반하는 화학반응으로서 보통 공기 중이나 산소 중에서 물질이 산화되는 반응을 말한다.

연소 계산
연료의 연소
– 고체상태
• 목탄, 석탄, 목재 등의 연소 방법에는 화격자 연소와 미분탄 연소가 있는데, 화격자 연소는 착화와 연소 속도가 느린 것이 결점이며, 미분탄 연소 속도는 미분탄 입자가 작을수록 빠름.
– 액체상태
• 휘발유, 등유, 경유, 중유는 대부분 분무화하여 연소시키는데, 고체 연료와 같이 분무입경이 작을수록 착화와 연소 속도가 빨라짐. 그 이외에도 연속 속도는 기름 방울과 공기의혼합률, 분진무각도, 연료의 예열온도 등에 의해 크게 지배를 받음.
– 기체 상태
• 공기와의 혼합율이 알맞으면 착화와 동시에 연소를 일으키는데, 이때 가스의 유출속도가 너무 빠르면 취소가 일어나고 늦으면 역화가 발생
고체 연료와 액체 연료의 특성
- 석유계 연료는 석탄계 연료에 비하여 발열량이 높다(석탄의 발열량은 5,000~8,000 kcal/kg, 석유의 발열량은 10,000 kcal/kg 이상이다).
- 석유계 연료의 연소시는 회분이 없으며 열효율이 높다.
- 석유계 연료는 동일 중량의 석탄계 연료보다 용적이 35~50 % 정도이다.
- 석유계 연료의 연소시는 과잉 공기량이 적고 쉽게 완전 연소되며 연소후 현탁액(slurry)이 없다.
- 석유계 연료는 연소의 조절이 간단하고 용이하며, 운반과 적재도 간단하고 신속하다.
연료의 연소이론
– 연료의 연소에 필요한 공기량 및 연소하여 발생된 연소가스량은 연료를 구성하는 가연원소 즉, 탄소 (C), 수소(H) 및 황(S) 등 3원소 의 연소에 필요한 산소량에 의해서 계산
| 반응식 | C + O2 → CO2 | H2 + ½ O2 → H2O | S + O2 → SO2 |
| 1 mol 질량 | 12kg 32kg 44kg | 2kg 16kg 18kg | 32kg 32kg 64kg |
| 1 mol 부피 | 22.4S㎥ 22.4S㎥ | 11.2S㎥ 22.4S㎥ | 22.4S㎥ 22.4S㎥ |
| 설명 | 탄소 12kg에 사용된 산소는 1mol 산소의 부피(22.4S㎥)와 질량(32kg) | 수소 2kg에 사용된 산소는 ½ mol 산소의 부피(11.2S㎥)와 질량(16kg) | 황 32kg에 사용된 산소는 1mol 산소의 부피(22.4S㎥)와 질량(32kg) |
* S㎥ = 표준 온도와 압력(standard temperature and pressure, STP) 상태의 용적 → 0℃, 1 atm
– 중량으로 계산

– 용적으로 계산
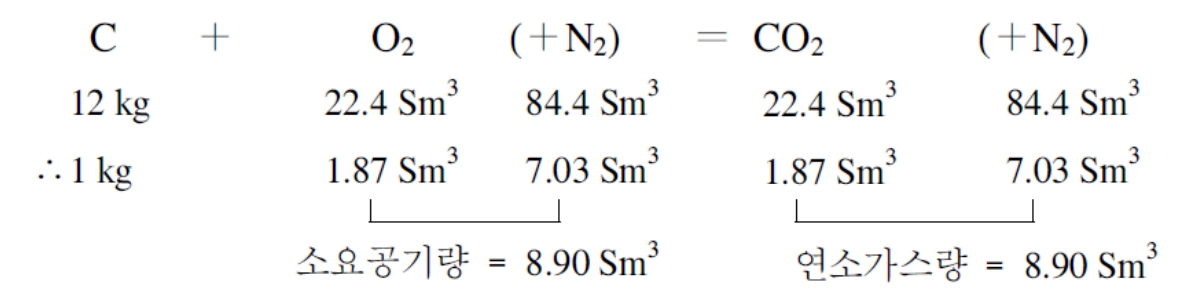
– 공기의 조성과 공기중 산소의 양
| 공기의 조성 | 산소 1kg(1㎥)에 대해 | ||
| 중량 (%) | 용 적 (%) | 중량비 | 용적비 |
| 산소 23 | 산소 21 | 공기 4.31 | 공기 4.77 |
| 질소 77 | 질소 79 | 질소 3.31 | 질소 3.77 |
이론 공기량 vs. 이론 산소량
연료를 이론적으로 완전연소시키는데 필요한 공기량(산소량)을 말한다.
– 액체 및 고체연료의 경우
• 부피를 기준 [S㎥-O2/kg-연료] :
[이론산소량]
Oo(S㎥-O2/kg-연료) = (22.4S㎥/12kg)C + (11.2S㎥/2kg)(H-⅛O)+ (22.4S㎥/32kg)S
= 1.867 C + 5.6 H - 0.7 O + 0.7 S [S㎥/kg]
[이론공기량]
Ao = Oo x 1/0.21 = 8.89C + 26.67H - 3.33O + 3.33S [S㎥/kg]
<유효수소 vs. 무효수소>
* 연료 속의 수소는 해당 연료 속의 산소와 결합하여 결합수가 되는 수소와, 공기 중의 산소와 결합하여 연소할 수 있는 수소(유효수소)가 있다. 즉, 연료 속에 산소(O)가 함유되어 있지 않을 경우에는 관계가 없지만 산소가 함유되어 있을 경우는 수소 전부가 연소하지 않는다. 왜냐하면 연료 중에 같이 포함되어 있는 산소와 결합하여 H₂O 를 생성하기 때문이다.
그래서 H₂+ ½ O₂ → H₂O 에서 수소 2개와 산소 1개가 결합을 하므로 수소 : 산소의 중량비는 1:8로서, 연료 속의 산소가 8㎏이 있다면 수소 1㎏을 연소시키지 않고 H₂O를 생성하게 된다. 즉, 수소량에서 O/8만큼 연소하지 않는다는 뜻이다.
(H - O/8)을 유효수소(탈 수 있는 수소)라 하고, O/8을 무효수소(탈 수 없는 수소)라 한다.
• 질량을 기준 [kg-O2/kg-연료] :
[이론산소량]
Oo(kg-O2/kg-연료) = (32kg/12kg)C + (16kg/2kg)(H-⅛O)+ (32kg/32kg)S
= 2.667 C + 8 H - 1 O + 1 S [kg/kg]
[이론공기량]
Ao = Oo x 1/0.232 = 11.49C + 34.48H - 4.31O + 4.31S [kg/kg]
– 기체 연료의 연소에 필요한 공기량
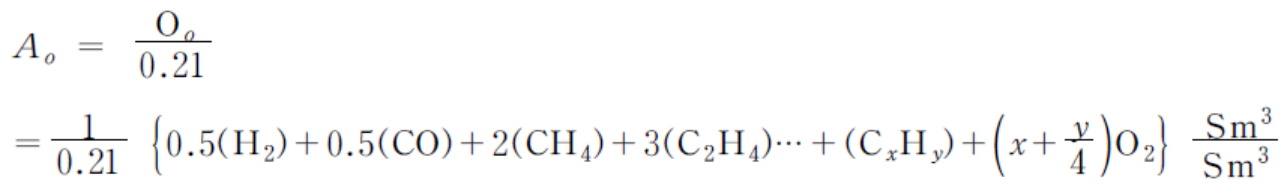
<표 1> 각종 연료의 이론공기량 근사치
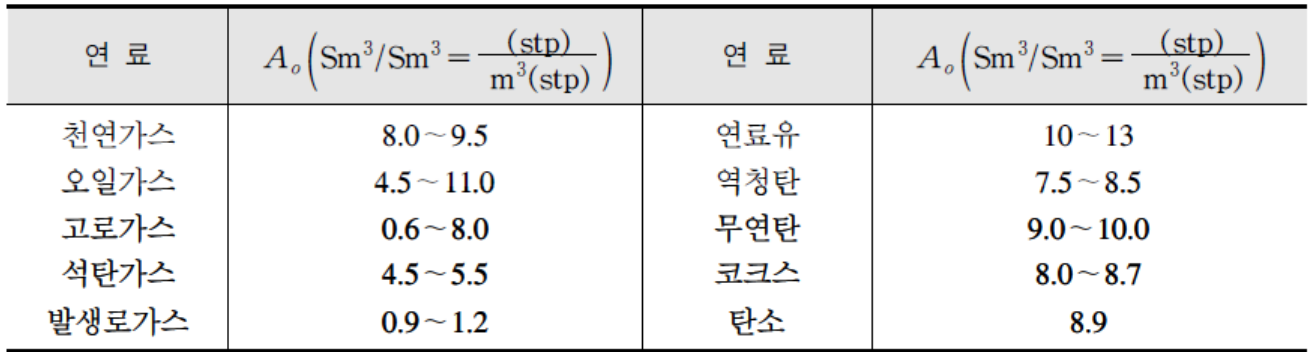
실제 소요 공기량
– 연소 장치에서 연소되는 모든 가연물질은 이론 공기량만으로는 완전연소시키기 어렵기 때문에 실제 연소시는 더 많은 양의 공기를 투입시켜 연소시키게 되는데 이 때 이론적인 공기량에 대한 실제 투입된 소요 공기량의 비를 과잉 공기비 또는 과잉 공기계수라 하고, m으로 표시한다.
m = A / Ao
– m: 공기비 >1, Ao: 이론 공기량, A: 실제 소요 공기량
– 과잉 공기율(AP )=(m-1)X100 %
– 과잉 공기량(AG)=(m-1)XAo
공기비
– 배기가스 분석치를 이용: 연소 배기가스의 조성을 이용하여 구하는 방법으로 배기가스의 조성은 오르자트 배기가스 분석법 등에 의해 측정이 가능
| 완전 연소시 | 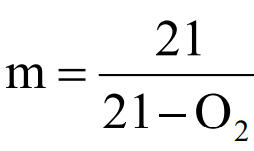 |
| 불완전 연소시 | 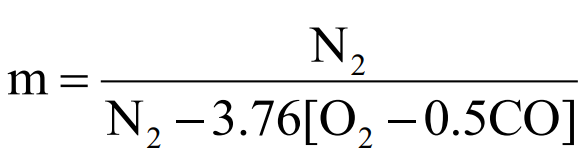 |
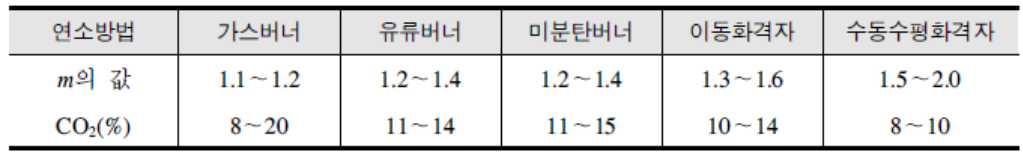
<표 2> 연소 방법과 공기비
이론적인 산소량과 연료의 관계
• 공기의 양이 적으면 배기가스 내에는 CO가 많고, 공기가 많게 되면 완전 연소
• 이론적으로 소요되는 공기량보다 더 넣어 주는 과잉공기(excess air)라고 하며, 화학적 이상연소에 필요한 공기량을 이론공기량(theoretical air)
• 과잉공기에 의해서 CO가 CO2로 산화되지만 동시에 연소온도가 감소되어 열손실 발생
• 보통의 경우에 0.5~5%의 열손실이 이루어지면 최적
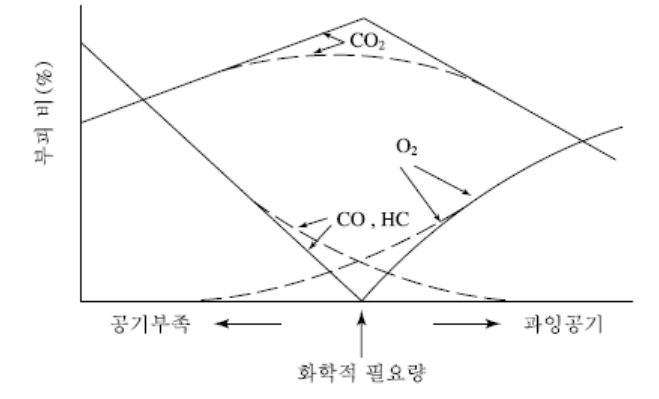
<그림 1> 화학적으로 연소에 소요되는 이론적인 산소량과 연료의 관계
Reference : 1. 한경대학교, 박성직, Organic Waste Treatment and Composting, Chapter 6. 폐기물의 연소 (1)
'공학 기술 > 공학기본' 카테고리의 다른 글
| 최소점화에너지 통제 (0) | 2024.05.19 |
|---|---|
| 정전기 관련 화재·폭발 원인 (0) | 2024.05.19 |
| 가스의 연소 (0) | 2024.05.06 |
| 내화구조 개요 (0) | 2024.04.21 |
| 무기화학제품 제조업 개요 (1) | 2024.04.18 |





댓글