화학물질의 흡열 반응 및 발열 반응에 있어서 엔탈피 변화(ΔH), 반응열, 결합에너지(Bond energy) 또는 결합 엔탈피와의 관계에 대해 공유하고자 한다.

흡열 반응 vs. 발열 반응
엔탈피 변화(ΔH)
엔탈피(enthalpy, H) 정의에 대해서는 기 포스팅한 다음 링크 자료 참조
https://sec-9070.tistory.com/1269
엔탈피(Enthalpy) 개념
열역학 제 1법칙을 이해하기 위해 엔탈피(enthalpy, H) 개념을 이해할 필요가 있어 이를 소개하고자 한다. 화학물질의 흡열 반응 및 발열 반응 이해에도 필요하다. 엔탈피(Enthalpy) 개념 엔탈피(enthalpy
sec-9070.tistory.com
엔탈피는 그 값의 기준을 어떤 점으로 잡느냐에 따라 변하기 때문에 그 자체로 쓰이는 것 보다는 계의 어떤 상태와 다른 상태 간의 엔탈피 차이(ΔH)를 표현하는 방식으로 쓰인다.
그리고 화학 물질의 엔탈피는 온도와 압력에 따라 달라지므로 온도와 압력을 표시한다. 온도와 압력이 표시되어 있지 않으면 25℃, 1기압 상태이다.
계의 엔탈피는 직접 측정하는 것은 사실상 불가능하며, 계의 엔탈피 변화로 대신 측정된다.
엔탈피 변화 (ΔH)는 다음 방정식으로 정의된다.
반응 엔탈피(ΔH) = 엔탈피 변화량 ≑ E출입량 ≑ Δ E (반응물 & 생성물) ≑ 반응열
ΔH = Hf - Hi
ΔH는 "엔탈피 변화량"이다.
Hf는 계의 최종 엔탈피이다.
Hi는 계의 초기 엔탈피이다.
화학반응에서의 엔탈피 변화는 열역적 계 또는 주위에서 관찰된 엔탈피의 변화를 설명하고, 화학반응이 완료된 후 엔탈피 값은 달라진다.
이는 생성물과 반응물간의 엔탈피 차이로 나타나는 현상으로,
엔탈피 변화값 (ΔH)은 (생성물의 엔탈피 값의 총합) - (반응물의 엔탈피 값의 총합)으로 나타 낼 수 있다.


<그림 1> 엔탈피의 변화와 발열 반응, 흡열 반응
열 화학 반응식
열 화학 반응식은 화학 반응식에 반응열을 함께 표시한 식으로 반응열은 화학 반응식의 맨 뒤에 쓴다.
물질의 상태에 따라 에너지 상태가 달라지므로 반드시 물질의 상태를 함께 나타내야 한다.

<그림 2> 열 화학 반응식 표시 예
반응열은 화학 반응이 일어나기 전후의 반응물과 생성물 간의 위치 에너지 차이를 말하며,
반응열 (Q)은 (반응물의 에너지 총합) - (생성물의 에너지 총합 )으로 나타 낼 수 있다.
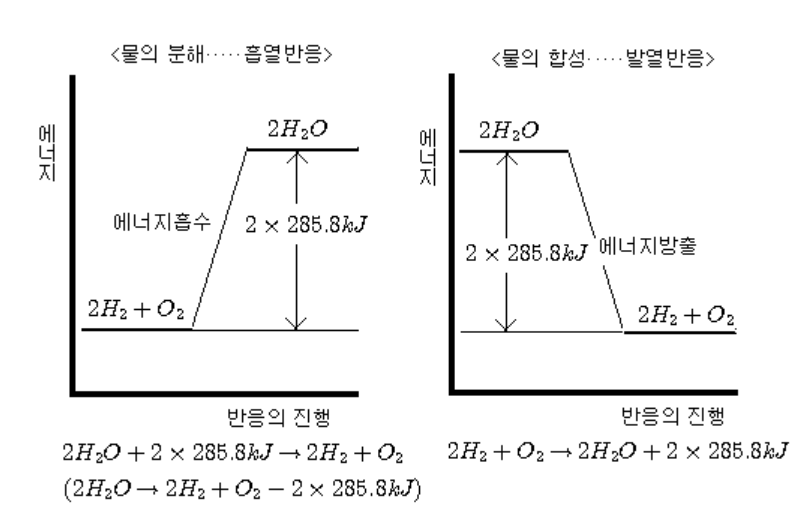
<그림 3> 물의 합성과 분해에 따른 에너지 변화(발열 반응과 흡열 반응)
| 엔탈피 변화값 (ΔH) | 반응열(Q) |
| ΔH = H(생성물) - H(반응물) | Q = Q(반응물) - Q(생성물) |
| - ΔH > 0: 흡열 반응 (반응물의 엔탈피 < 생성물의 엔탈피) - ΔH < 0 : 발열 반응 (반응물의 엔탈피 > 생성물의 엔탈피) |
- Q < 0 : 흡열 반응 (반응계 에너지 < 생성계 에너지) - Q > 0 : 발열 반응 (반응계 에너지 > 생성계 에너지) |
결합에너지(Bond energy, BE)
결합 에너지(Bond energy, BE), 또는 결합 엔탈피는 화학 결합의 세기를 측정하는 방식으로, 결합 에너지는 화학결합을 분리/해리하는데 필요한 엔탈피 변화(에너지 변화)량을 말한다.
- 분리 보다 결합되어 있을 때, 에너지 측면에서 얼마나 안정한가를 나타내는 척도로서, 결국 결합 엔탈피가 클수록 화학결합이 안정함을 나타낸다.
- 같은 종류의 분자에서 같은 종류의 결합을 끊는데 필요한 에너지는 항상 동일하다.
결합 에너지가 클 수록 분자의 에너지준위가 더 낮아지고, 따라서 화학결합이 더 안정하다.
결합에너지는 결합의 세기를 나타내는 척도라고도 볼 수 있다.
결합이 강할수록 결합을 끊는데의 에너지가 많이 소요된다.
결합에너지는 결합이 강할수록, 극성이 클수록, 단일결합 보다는 다중 결합일수록 증가한다.
예 1) HF, HCl, HBr, HI가 있을 때 결합의 극성은 HF > HCl> HBr> HI이다. 극성이 클수록 결합에너지가 크므로 결합에너지도 HF > HCl> HBr> HI이다.
예 2) C2의 단일 결합보다는 이중 결합이 이중결합보다는 삼중 결합이 결합에너지가 큰것이다.
화학반응은 원자의 재배열이라 볼 수 있는데 화학반응이 있기 위해서는 분자의 결합이 끊어져야 한다.
화학결합을 끊으려면 입자들 사이의 인력을 끊을 수 있는 만큼의 에너지가 필요하다.
분자의 에너지가 준위가 더 낮으면 더 안정하고, 더 안정한 화합물의 결합을 깨뜨리려면 더 많은 에너지가 필요하다.
어떤 결합을 깨뜨리는데 더 많은 에너지가 필요할수록 그 결합은 더 강한 결합이다.
- 발열 반응: 생성물의 결합에너지 > 반응물의 결합에너지
- 흡열 반응: 생성물의 결합에너지 < 반응물의 결합에너지
발열 반응 vs. 흡열 반응
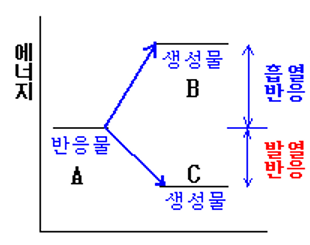
<그림 4> 화학반응의 에너지 변화(흡열 반응과 발열 반응)
| 발열 반응 | 흡열 반응 | |
| 엔탈피 변화 (ΔH) |
에너지가 외부로 방출되는 반응이다.(온도 상승) ● 반응물의 엔탈피 > 생성물의 엔탈피 (ΔH < 0) |
열에너지를 흡수하는 반응이다.(온도 저하) → 흡수한 에너지는 생성물이 결합하는 데 사용 ● 반응물의 엔탈피 < 생성물의 엔탈피 (ΔH > 0) |
| 반응열 (Q) | 에너지를 방출하여 엔탈피가 감소한다. ● 반응계 에너지 > 생성계 에너지 (Q > 0) |
에너지를 흡수하여 엔탈피가 증가한다. ● 반응계 에너지 < 생성계 에너지 (Q < 0) |
| 결합 에너지 (Bond energy) |
생성물의 에너지 준위가 반응물보다 더 낮다. ● 생성물의 결합에너지 > 반응물의 결합에너지 |
생성물의 에너지 준위가 반응물보다 더 높다. ● 생성물의 결합에너지 < 반응물의 결합에너지 |
Reference : 1. https://ko.wikipedia.org/wiki/엔탈피
2.https://ko.wikipedia.org/wiki/결합 에너지
'공학 기술 > 공학기본' 카테고리의 다른 글
| 정전기의 유도 및 축적 (1) | 2024.02.22 |
|---|---|
| 정전기 발생 이해 (0) | 2024.02.21 |
| 엔탈피(Enthalpy) 개념 (1) | 2024.02.08 |
| 증기압(Vapor Pressure) 추정 (1) | 2023.12.19 |
| Heat Transfer(열 전달) 형태 (1) | 2023.12.07 |





댓글